题目内容
高铁酸钾(K2FeO4)是集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下: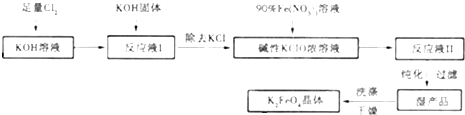
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12=5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KC1O+10KOH=2K2FeO4+6KNO3+2KCl+5H2O
回答下列问题:(1)该工艺应在
(2)K2FeO4可作为新型多功能水处理剂的原因
(3)在“反应液I”中加KOH固体的目的是①
(4)从“反应液II”中分离出K2FeO4后,副产品是
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压高铁电池的总反应3Zn+2K2FeO4+8H2O
| 放电 | 充电 |
①写出该电池充电时阳极的电极反应式
②下列叙述正确的是
A.Zn电极在放电时作负极,发生氧化反应
B.该电池放电时,K+向负极移动
C.放电时正极有1mol K2FeO4被还原,则转移3mol电子
③用该电池电解200mL 1mol?L-1 的AgNO3溶液(用惰性电极),当阴极质量增加2.16g时,被电解溶液的pH为
分析:(1)由①2KOH+Cl2═KCl+KClO+H2O(条件:温度较低)、②6KOH+3Cl2═5KCl+KClO3+3H2O(条件:温度较高),可知温度低反应生成KClO;
(2)Fe为+6价,具有强氧化性,且还原产物铁离子,水解生成胶体,具有吸附性;
(3)“反应液Ⅰ”中加KOH固体,可除去过量氯气,且为下一步反应提供反应物;
(4)由2Fe(NO3)3+2KClO+10KOH═2K2FeO4+6KNO3+3KCl+5H2O可知,反应的副产物;
(5)①根据充电时阳极发生氧化反应及电池的总反应写出阳极发生的电极反应式;
②根据原电池工作原理、电池总反应进行判断;
③电解硝酸银溶液时阴极析出银,根据银的物质的量计算出溶液中的氢离子浓度及溶液的pH.
(2)Fe为+6价,具有强氧化性,且还原产物铁离子,水解生成胶体,具有吸附性;
(3)“反应液Ⅰ”中加KOH固体,可除去过量氯气,且为下一步反应提供反应物;
(4)由2Fe(NO3)3+2KClO+10KOH═2K2FeO4+6KNO3+3KCl+5H2O可知,反应的副产物;
(5)①根据充电时阳极发生氧化反应及电池的总反应写出阳极发生的电极反应式;
②根据原电池工作原理、电池总反应进行判断;
③电解硝酸银溶液时阴极析出银,根据银的物质的量计算出溶液中的氢离子浓度及溶液的pH.
解答:解:(1)由①2KOH+Cl2═KCl+KClO+H2O(条件:温度较低)、②6KOH+3Cl2═5KCl+KClO3+3H2O(条件:温度较高),可知温度低反应生成KClO,温度高不生成KClO,
故答案为:温度较低;
(2)Fe为+6价,具有强氧化性,且还原产物铁离子,水解生成胶体,具有吸附性,则K2FeO4可作为新型多功能水处理剂的原因为+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,且还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉,
故答案为:+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,且还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(3)氯气与KOH溶液反应时足量,且信息③中的反应在碱性条件,则“反应液Ⅰ”中加KOH固体,可与“反应液I”中过量的Cl2继续反应,生成更多的KClO,且为下一步反应提供反应物,
故答案为:与“反应液I”中过量的Cl2继续反应,生成更多的KClO;
(4)由2Fe(NO3)3+2KClO+10KOH═2K2FeO4+6KNO3+3KCl+5H2O可知,分离出K2FeO4后,副产品是KNO3、KCl,
故答案为:KNO3、KCl;
(5)①充电时阳极发生氧化反应,Fe(OH)3发生氧化反应生成K2FeO4,电极方程式为:Fe(OH)3+5OH--3e-=FeO42-+4H2O,
故答案为:Fe(OH)3+5OH--3e-=FeO42-+4H2O;
②A.放电时负极发生氧化反应,电池总反应中放电时锌化合价升高,所以Zn电极在放电时作负极,故A正确;
B.该电池放电时,电流在溶液中由负极流向正极,所以K+向正极移动,故B错误;
C.放电时正极铁元素化合价由+6变成+3,化合价降低了3价,若有1mol K2FeO4被还原,则转移3mol电子,故C正确;
故答案为:A C;
③2.16g银的物质的量为:
=0.02mol,则溶液中氢氧根离子有0.02mol放电,同时生成了0.02mol氢离子,被电解的溶液中氢离子浓度为:
=0.1mol/L,该溶液的pH=1,
故答案为:1.
故答案为:温度较低;
(2)Fe为+6价,具有强氧化性,且还原产物铁离子,水解生成胶体,具有吸附性,则K2FeO4可作为新型多功能水处理剂的原因为+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,且还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉,
故答案为:+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,且还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(3)氯气与KOH溶液反应时足量,且信息③中的反应在碱性条件,则“反应液Ⅰ”中加KOH固体,可与“反应液I”中过量的Cl2继续反应,生成更多的KClO,且为下一步反应提供反应物,
故答案为:与“反应液I”中过量的Cl2继续反应,生成更多的KClO;
(4)由2Fe(NO3)3+2KClO+10KOH═2K2FeO4+6KNO3+3KCl+5H2O可知,分离出K2FeO4后,副产品是KNO3、KCl,
故答案为:KNO3、KCl;
(5)①充电时阳极发生氧化反应,Fe(OH)3发生氧化反应生成K2FeO4,电极方程式为:Fe(OH)3+5OH--3e-=FeO42-+4H2O,
故答案为:Fe(OH)3+5OH--3e-=FeO42-+4H2O;
②A.放电时负极发生氧化反应,电池总反应中放电时锌化合价升高,所以Zn电极在放电时作负极,故A正确;
B.该电池放电时,电流在溶液中由负极流向正极,所以K+向正极移动,故B错误;
C.放电时正极铁元素化合价由+6变成+3,化合价降低了3价,若有1mol K2FeO4被还原,则转移3mol电子,故C正确;
故答案为:A C;
③2.16g银的物质的量为:
| 2.16g |
| 108g/mol |
| 0.02mol |
| 0.2L |
故答案为:1.
点评:本题考查K2FeO4的制备实验方案的设计、原电池、电解质工作原理,把握流程中的反应及信息中的反应为解答的关键,注意混合物分离提纯方法及原电池反应,侧重分析能力和知识灵活应用能力的考查,综合性较强,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为