题目内容
(1)常温下,将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)(2)常温下,若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得溶液的pH不等于7,则该混合溶液的pH
分析:(1)将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,二者恰好反应,反应后溶液显示酸性,说明生成了强酸弱碱盐,常见了水的电离;而氯化氢溶液抑制了水的电离,据此进行判断;
(2)先根据HR为强电解质进行判断,然后得出HR为弱酸,然后根据酸过量得出溶液显示酸性.
(2)先根据HR为强电解质进行判断,然后得出HR为弱酸,然后根据酸过量得出溶液显示酸性.
解答:解:(1)常温下,将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,氯化氢和MOH恰好反应生成MCl,测得混合溶液的pH=6,溶液显示酸性,说明MCl为强酸弱碱盐,溶液中水的电离程度增大,水电离的氢离子为溶液中的氢离子浓度,即c(H+)=1×10-6mol/L;而氯化氢为酸溶液,抑制了水的电离,所以混合溶液中由水电离出的c(H+)大于盐酸中水电离的氢离子浓度,
故答案为:>;
(2)HR若为强电解质,二者都是一元酸或碱,等体积混合后溶液的pH=7,而现在溶液pH不等于7,说明HR为弱电解质,二者混合后溶液中酸过量,反应后溶液显示酸性,溶液pH<7,
故答案为:<.
故答案为:>;
(2)HR若为强电解质,二者都是一元酸或碱,等体积混合后溶液的pH=7,而现在溶液pH不等于7,说明HR为弱电解质,二者混合后溶液中酸过量,反应后溶液显示酸性,溶液pH<7,
故答案为:<.
点评:本题考查了溶液pH的简单计算,题目难度中等,注意掌握酸碱混合后溶液酸碱性判断及溶液pH的计算方法,(2)为易错点,注意HR为弱酸,酸过量,反应后的溶液显示酸性,不是根据生成强碱弱酸盐判断溶液显示碱性.

练习册系列答案
相关题目
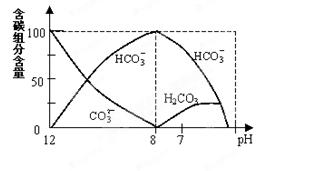
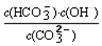 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
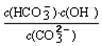 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=
。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=
。