题目内容
下列顺序不正确的是
| A.热稳定性:HF>HCl>HBr>HI |
| B.微粒的半径:Cl->Na+>Mg2+>Al3+ |
| C.电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3 |
| D.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
C
解析试题分析:A、根据同主族元素性质递变规律:同主族元素气态氢化物的稳定性由上到下逐渐减弱,正确;B、根据微粒半径大小比较原则可知,Cl-核外三个电子层,Na+ 、 Mg2+ 、 Al3+核外两个电子层则Cl-半径最大,Na+ 、 Mg2+ 、 Al3+电子层结构相同,核电荷数越大半径越小,即Cl->Na+>Mg2+>Al3+,正确;C、HCl和NaHCO3是强电解质,全部电离,CH3COOH为弱电解质,部分电离,错误;D、分散质粒子的直径:溶液小于1 nm 、胶体1 nm~100 nm、浊液大于100 nm,正确。
考点:考查元素周期律和物质分类相关知识

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素。下列说法错误的是
| | W | Z |
| X | Y | |
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y<W
D.W、Z的氧化物都能与碱反应生成盐和水
自然界中存在的碘的稳定性核素是碘-127(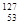 I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(
I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(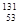 I)。碘-131 (
I)。碘-131 (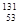 I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是( )
I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是( )
A.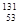 I2和 I2和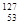 I2互为同素异形体 I2互为同素异形体 | B.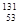 I和 I和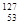 I互为同位素 I互为同位素 |
C.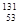 I的摩尔质量为131 I的摩尔质量为131 | D.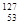 I中子数与质子数之差为74 I中子数与质子数之差为74 |
下列关于原子结构、元素性质的说法正确的是:
| A.Na2O2中既含离子键,又含非极性键,阴阳离子个数之比为1:1 |
| B.第IA族又名碱金属族 |
| C.1H35Cl、2H37Cl两种气体的化学性质相同,但物理性质可能不同 |
| D.由于还原性:S2->Cl-,故硫元素的非金属性强于氯元素 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是
| A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D.Z的氢化物比X的氢化物更稳定 |
若元素X位于ⅠA族,Y为短周期元素,X与Y可形成化合物X2Y,下列说法正确的是( )
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1:1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
下列分子中所有原子都满足最外层为8个电子结构的是
| A.BF3 | B.H2O | C.SiCl4 | D.PCl5 |
下列判断错误的是
A.沸点: |
B.熔点: |
C.酸性: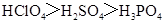 |
D.碱性: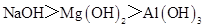 |



