题目内容
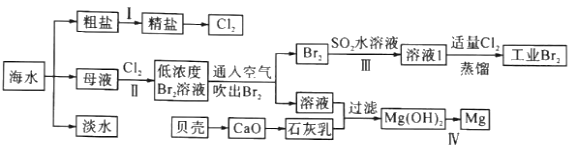
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2需要消耗_________molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C. ![]() D.
D. ![]()
(5)判断Mg(OH)2是否洗涤干净的操作是________________________________________。
【答案】Ca2++CO32-=CaCO3↓ Ba2++ CO32-=BaCO3↓2抑制氯气和水反应Br2+SO32-+H2O=SO42-+2H++2Br-NaBr(或溴化钠)D取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净
【解析】
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,可依次加入过量BaCl2(除去硫酸根离子)、Na2CO3(除去钙离子的多余的钡离子)、NaOH(除去镁离子),最后加适量盐酸调节溶液的pH等于7后蒸发即可,所以加入Na2CO3溶液后相关化学反应的离子方程式为:Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓。
(2)流程中海水提溴,先向母液中通入Cl2将Br-氧化为Br2,再用SO2将其还原为Br-,最后再通入Cl2将Br-氧化为Br2,所以制得1molBr2需要消耗2molCl2。因为氯气和水能发生反应,所以步骤Ⅱ中需要向母液中加入稀硫酸酸化,抑制氯气和水的反应。步骤Ⅱ若用Na2SO3水溶液吸收Br2,SO32-被氧化成SO42-,Br2被还原为Br-,反应的离子方程式为:Br2+SO32-+H2O=SO42-+2H++2Br-。
(3)因为氯气与溴化钠反应生成溴和氯化钠,除去Br2中残留的少量Cl2,可向其中加入NaBr(或溴化钠)溶液。
(4)电解MgCl2溶液得不到单质Mg,氧化镁熔点很高,应电解熔融的MgCl2制取单质Mg,所以D项制取单质镁的方法最合适。
(5)判断Mg(OH)2是否洗涤干净,就是检验最后一次洗涤液中是否存在Cl-,具体操作为:取最后一次洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明Mg(OH)2已经洗涤干净。

【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 选项 | a | b | c |
A | Al | AlCl3 | Al(OH)3 | |
B | CO2 | Na2CO3 | NaHCO3 | |
C | Si | SiO2 | H2SiO3 | |
D | S | SO3 | H2SO4 |
A. A B. B C. C D. D