题目内容
14.下列叙述不正确的是( )| A. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 原子中核外电子排布的周期性变化是产生元素周期律的根本原因 | |
| D. | 核素就是同位素 |
分析 A.化学反应为原子重新组合的过程,存在化学键的断裂和形成;
B.化学键包括离子键和共价键;
C.元素周期率的实质为原子中核外电子排布的周期性变化;
D.根据同位素、核素的定义判断.
解答 解:A.化学反应为原子重新组合的过程,存在化学键的断裂和形成,所以化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程,故A正确;
B.化学键包括离子键和共价键,则可以使离子相结合,也可以使原子相结合,故B正确;
C.元素周期律就是元素性质的周期性变化规律,性质是有结构决定,所以元素周期律的实质就是原子核外电子的排布的周期性变化,故C正确;
D.核素是指的单一的原子,而同位素是同种元素的不同原子之间的互称,故D错误.
故选:D.
点评 本题考查较综合,涉及同位素、化学键及元素周期律等,注重基础知识的考查,注意把握问题的实质,题目难度不大.

练习册系列答案
相关题目
5.某气态烃1体积只能与1体积HBr发生加成反应,生成溴代烷,此溴代烷1mol可与7mol Cl2发生完全取代反应,则该烃的结构简式为( )
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH2=CH-CH=CH2 |
2.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一 配制并标定醋酸溶液的浓度取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.
回答下列问题:
(1)配制250mL 0.2mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定醋酸溶液的准确浓度,用0.2000mol.L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol•L-1.(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:0.0100mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将增大(填“增大”减小”或“不变”)
实验一 配制并标定醋酸溶液的浓度取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.
回答下列问题:
(1)配制250mL 0.2mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定醋酸溶液的准确浓度,用0.2000mol.L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol•L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:0.0100mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将增大(填“增大”减小”或“不变”)
9.根据相似相溶规则和实际经验,下列叙述不正确的是( )
| A. | 白磷(P4)易溶于CS2,但难溶于水 | B. | NaCl易溶于水,难溶于CCl4 | ||
| C. | 碘易溶于苯,微溶于水 | D. | 卤化氢易溶于水,也易溶于CCl4 |
6.结构不同的二甲基氯苯的数目有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
3.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | XeF4 | B. | SF6 | C. | CCl4 | D. | BF3 |
4.铝热反应是铝的一个重要性质.某校化学兴趣小组同学,取磁性氧化铁在如图1实验装置进行铝热反应,冷却后得到“铁块”混合物.
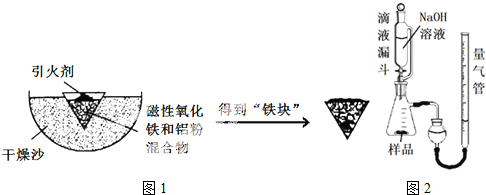
(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.
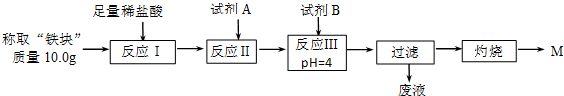
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.

(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.
 .
. .
. .
. 、
、 ;
;