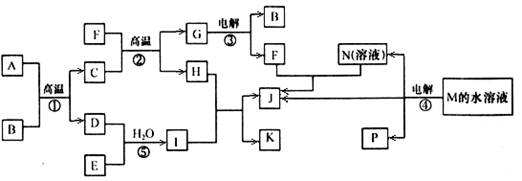
题目内容
(8分)已知有以下物质相互转化:

试回答:
(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN溶液鉴别G溶液的离子方程式 ;
向G溶液加入A的有关离子方程式 。
(1)FeCl2 KCl
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Fe3++3SCN-=Fe(SCN)3 2Fe3++Fe=3Fe2-

(12分)
Ⅰ.已知常温下,AgCl的Ksp=1.8×10-10,AgBr的Ksp=4.9×10-13。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-) (填“变大”、“变小”或“不变”,下同);
②若改加更多的AgCl固体,则c(Ag+) ;
③若改加更多的KBr固体,则c(Ag+) ,c(Cl-) ;
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是 ;
| A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大 |
| B.两种难溶盐电解质,其中Ksp小的溶解度也一定小 |
| C.难溶盐电解质的Ksp与温度有关 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
(1)以辛烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- -50e-==8CO2 + 9H2O,,正极的电极反应式为 。固体电解质里O2-的移动方向是 ,向外电路释放电子的电极是 。
(11分)(2011·滨州模拟)Ⅰ.回答下列有关常数的问题:
(1)Kw的数学表达式是________,温度升高Kw________(选填“变大”“变小”或“不变”),若定义pOH=-lgc(OH-),则pH+pOH=________(用含Kw的代数式表示)。
(2)Ka通常表示弱酸的电离平衡常数,Ka值越大表示该弱酸的酸性________。α通常称为电离度,顾名思义是表示弱电解质的电离程度大小的一个指标,对于某一元弱酸,当用蒸馏水稀释该酸时,Ka________(选填“变大”“变小”或“不变”)。α________(选填“变大”“变小”或“不变”)。
(3)Ksp表示难溶物的溶度积常数,该常数越大表示________。
Ⅱ.已知常温下,AgBr的Ksp=4.9×10-13mol2·L-2、AgI的Ksp=8.3×10-17mol2·L-2。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”“变小”或“不变”,下同);
②若改加更多的AgI,则c(Ag+)________;
③若改加AgBr固体,则c(I-)______;而c(Ag+)______。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是________。
| A.两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变 |
| C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 |
F.同离子效应(加入与原电解质具有相同离子的物质),使难溶盐电解质的溶解度变小,也使Ksp变小
(3)现向含有NaBr、KI均为0.002 mol·L-1的溶液中加入等体积的浓度为4×10-3 mol/L AgNO3溶液,则产生的沉淀是________(填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应方程式表示为:______________________________。

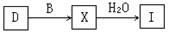
 2X(g);△H = – 196.6KJ/mol,当2 mol D与1
mol B在该条件下反应达平衡时反应放热186.8 KJ。
2X(g);△H = – 196.6KJ/mol,当2 mol D与1
mol B在该条件下反应达平衡时反应放热186.8 KJ。