题目内容
【题目】(10分)某化学探究小组用如下实验证明了烧碱与稀硫酸能发生中和反应。
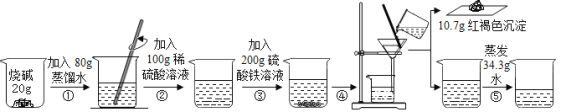
②③两步均充分反应,加入硫酸铁溶液,立即产生明显现象,最终得到只含一种溶质的无色溶液.请回答下列问题:
(1)①根据发生的反应及现象可知反应②结束时溶液中的离子有_____________(填离子符号);②无明显现象,发生反应的化学方程式是_____________;
(2)求解③中参加反应的烧碱的质量为_____________;
(3)发生中和反应的硫酸的物质的量为_____________ ;
(4)最终得到的无色不饱和溶液只含一种溶质,则所得溶液中溶质的质量分数为_____________。
【答案】(1)①Na+、OH-、SO42-;②H2SO4+2NaOH=Na2SO4+2H2O;
(2)12g;
(3)0.1mol;
(4)10%。
【解析】
试题分析:(1) ①根据发生的反应2NaOH+H2SO4=Na2SO4+2H2O可知及加入硫酸铁溶液会产生红褐色沉淀,说明碱过量,实验反应②结束时溶液中的离子有:Na+、OH-、SO42-;②硫酸与氢氧化钠发生酸碱中和反应,产生硫酸钠和水,反应的化学方程式是:H2SO4+2NaOH=Na2SO4+2H2O;(2)设与硫酸铁反应的氢氧化钠的质量为x,生成的硫酸钠的质量为y;
Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3 ↓
240 426 214
x y 10.7g
214÷240=10.7g÷x,解得x=12g;426÷214=y÷10.7g,解得y=21.3g;反应开始有NaOH质量是20g,所以发生反应③消耗的NaOH的质量是20g-12g=8g;(3)硫酸与NaOH发生中和反应:2NaOH+ H2SO4= Na2SO4+2H2O,反应的NaOH的质量是20g-12g=8g,其物质的量是n(NaOH)=8g÷40g/mol=0.2mol,根据反应方程式可知硫酸的物质的量是n(H2SO4)=1/2 n(NaOH)=0.1mol;(4)设氢氧化钠与硫酸反应生成的硫酸钠的质量为z,
2NaOH+H2SO4=Na2SO4+2H2O
80 142
8g z
80÷142=8g÷z,解得 z=14.2g;因此最终得到的无色不饱和溶液中溶质的质量分数=
[(21.3g+14.2g)÷(20g+80g+100g+200g10.7g34.3g)]×100%=10%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案