题目内容
在下列实验中,不能达到目的的是
- A.用饱和NaHSO3溶液除去SO2气体中混有的HCl
- B.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
- C.进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱
- D.测定NaCl和NaF溶液的pH,确定F、Cl两元素非金属性的强弱
D

练习册系列答案
相关题目
下列实验现象的描述错误的是( )
| A、CuSO4溶液不能产生丁达尔现象,Fe(OH)3胶体能产生丁达尔现象 | B、向石蕊试液中加入新制氯水,石蕊试液变红后一直保持 | C、向淀粉KI溶液中滴加少量新制氯水,溶液变蓝色 | D、在新制氯水和久置氯水中滴加AgNO3溶液都有白色沉淀生成 |
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.


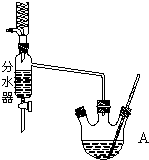 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: