题目内容
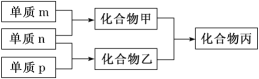
【题目】短周期主族元素 X、Y、Z 的单质 m、n、p 在通常状况下均为气态双原子分子,其中 m 含共用电子对数最多;甲、乙分别为 10 电子、18 电子分子,它们的转化关系如下图所 示(反应条件略去)。下列说法正确的是
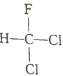
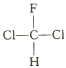
A. X 是同周期中非金属性最强的元素
B. 元素 X、Y、Z 的原子半径大小关系为 X<Y<Z
C. Z 的氧化物对应的水化物的酸性在主族元素中最强
D. 化合物丙是离子化合物,既含离子键又含共价键
【答案】D
【解析】
常见双原子单质分子中,含共价键数目最多的是N2,即m为N2,分子中含有3个共价键,单质m、n、p在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,甲分子含10个电子,乙分子含18个电子,则化合物甲为NH3,n为H2,乙为氢化物,含有18个电子,乙为HCl,则p为Cl2,丙为NH4Cl,可知X为N、Y为H,Z为Cl元素,以此解答该题。
由以上分析可知X为N、Y为H,Z为Cl元素,
A.N位于第二周期,非金属性最强的为F元素,选项A错误;
B.H为元素周期表中原子半径最小的原子,应为Y<X<Z,选项B错误;
C.应为最高价氧化物的水化物,如不是最高价,则酸性不一定最强,选项C错误;
D.化合物丙为氯化铵,为离子化合物,含有离子键和共价键,选项D正确。
答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目