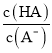��Ŀ����
����Ŀ�������ҹ�����ϲ������Ʒ������ijУ��ѧ��ȤС���ͬѧ�������ʵ�������Լ����Ҷ�к���Ca��Al��Fe����Ԫ�ء�
��֪�������[(NH4)2C2O4]����������ʡ������(CaC2O4)������ˮ��Ca2����Al3����Fe3����ȫ������pHΪCa(OH)2��pH��13��Al(OH)3��pH��5.5��Fe(OH)3��pH��4.1��

������������̼���Ϣ��գ�
��1������ڼ������������________________��
��2��д������Ca2�������ӷ���ʽ__________________________��
��3��д������C������Ҫ���ʵĻ�ѧʽ________________________��
��4��д���������A�Լ����ɺ�ɫ��Һ�����ӷ���ʽ__________________________��
��5��������������_____________________________________��
��6����ȡ400 g��Ҷ��Ʒ���յûҷۺ�������������ˣ���������Һ���������(NH4)2C2O4��Һ���ٹ��ˡ�ϴ�ӡ���������õ�5.12 g������ԭ��Ҷ�и�Ԫ�ص���������Ϊ________��
���𰸡� ʹCa2����Al3����Fe3������(��ʹCa2����Al3����Fe3���ܽ�) Ca2����(NH4)2C2O4===CaC2O4����2NH�� Fe(OH)3��Al(OH)3 Fe3����3SCN��Fe(SCN)3 ʹFe3��ת��ΪFe(OH)3���� 0.400%
����������Ҷ�����գ���Ҷ���к��иơ����������ֽ���Ԫ�أ��������������ɿ����Ե��Ȼ�������˺�����Һ�м��백ˮ����pH6��7����������30min�������˵õ��ij���CΪ��������������������������ҺΪ�Ȼ�����Һ���������狀�ɵò���Ƴ���������Һ�м���������Ϊ���ݣ������Լ�A����Һ��ɺ�ɫ����AӦΪKSCN��Һ����Һ2�м���6mol/L��NaOH��Һ��pH��4���ɵõ�����������������Һ���÷ֲ���ϲ���ҺΪ�Ȼ�����Һ�������Լ�B�ɼ��������ӣ����ɺ�ɫ������1��������������֪����������Ҷ�ҷ��м�����������ǽ����е�Ca2+��Al3+��Fe3+�ܽ⣻��2���ݹ��˺�������Һ�к�Ca2+������Ca2+�����ӷ���ʽΪ��Ca2++��NH4��2C2O4=CaC2O4��+2NH4+����3���������pHΪ6-7ʱ����30 min����ʹAl3+��Fe3+ת���ɳ�����������CΪAl(OH)3��Fe(OH)3��������4��������Ǽ���Fe3+���ɼ���KSCN ��NH4SCN���м��飬��Һ���ɫ����Ӧ�����ӷ���ʽΪ��Fe3++3SCN-=Fe(SCN)3����5������ὫpHֵ������4��5����ʱ������û�г����������ӳ�����ȫ������ʹFe3+ת��ΪFe(OH)3��������6��5.12g����ΪCaC2O4����CaԪ�ص�����Ϊ5.12g��![]() ��100%=1.6g����ԭ��Ҷ�и�Ԫ�ص���������Ϊ
��100%=1.6g����ԭ��Ҷ�и�Ԫ�ص���������Ϊ![]() ��100%=0.400%��
��100%=0.400%��