题目内容
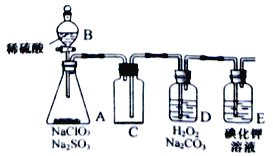
【题目】电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se,工业上从其中回收硒(Se)、碲(Te)的一种工艺流程如下:
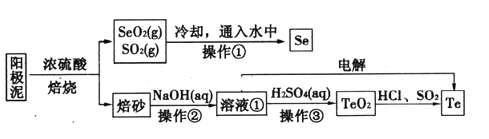
已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
(1)SeO2与SO2通入水中反应的化学方程式为_____________________________操作①的名称为__________。
(2)焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、_______。工业上通过电解溶液①也可得到单质碲。已知电极均为石墨,则阴极的电极反应式为___________________________。
(3)向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是_________________________________。
(4)将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为__________________。
【答案】SeO2+2SO2+2H2O=2H2SO4+Se↓ 过滤 Na2TeO3 TeO32-+3H2O+4e-=Te+6OH- TeO2 是两性氧化物,溶液酸性过強,TeO2 会继续与酸反应导致碲元素损失 Te4++2SO2+4H2O=Te+8H++2SO42-
【解析】
(1)根据流程图,SeO2与SO2在冷却后通入水中反应生成Se,此为还原产物,则氧化产物为H2SO4,结合氧化还原反应的电子守恒,写出发生反应的化学方程式;Se单质难溶于水,根据固液分离选择操作方法;
(2)TeO2微溶于水,易溶于较浓的强酸和强碱,是两性氧化物,TeO2与足量NaOH溶液反应生成盐和水;工业上也可以通过电解溶液①得到单质碲,电解时的电极均为石墨,阴极发生还原反应,TeO32-得到电子生成Te;
(3)TeO2微溶于水,易溶于较浓的强酸和强碱,加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀时,如果H2SO4过量,会继续溶解TeO2沉淀;
(4)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,二氧化硫被氧化生成硫酸,根据电子守恒、电荷守恒及原子守恒写反应的离子方程式。
(1)根据流程图,SeO2 与SO2在冷却后通入水中反应生成Se,反应的化学方程式为SeO2+2SO2+2H2O=2H2SO4+Se↓,Se单质难溶于水,反应后分离出Se单质可以通过过滤方法分离;
(2)TeO2微溶于水,易溶于较浓的强酸和强碱。焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为Na2TeO3。工业上也可以通过电解溶液①得到单质碲,电解时电极均为石墨,阴极发生还原反应,TeO32-在阴极得到电子被还原生成Te,电极反应式为TeO32-+3H2O+4e-=Te+6OH-;
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。向溶液①中加入硫酸时控制溶液的pH为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,溶液酸性过強,TeO2 会继续与酸反应,导致碲元素损失,使碲的回收率偏低;
(4)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,二氧化硫被氧化生成硫酸,反应的离子方程式为Te4++2SO2+4H2O=Te+8H++2SO42-。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案