题目内容
下列说法中错误的是( )
| A、当中心原子的配位数为6时,配合单元常呈八面体空间结构 | B、[Ag(NH3)2]+中Ag+空的5S轨道和5P轨道以sp杂化成键 | C、配位数为4的配合物均为正四面体结构 | D、已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型 |
分析:A.中心原子以sp3d2杂化时为八面体(等性杂化为正八面体);
B.Ag+的配位数是2,银原子以sp方式发生杂化;
C.配位数为4的配合物可能为平面结构;
D.中心原子采用sp杂化时该微粒是直线型结构.
B.Ag+的配位数是2,银原子以sp方式发生杂化;
C.配位数为4的配合物可能为平面结构;
D.中心原子采用sp杂化时该微粒是直线型结构.
解答:解:A.中心原子以sp3d2杂化时为八面体(等性杂化为正八面体),如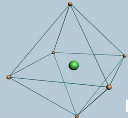 ,所以当中心原子的配位数为6时,配合单元常呈八面体空间结构,故A正确;
,所以当中心原子的配位数为6时,配合单元常呈八面体空间结构,故A正确;
B.[Ag(NH3)2]+中Ag+空的5S轨道和5P轨道以sp杂化成键,所以其空间构型为直线型结构,故B正确;
C.配位数为4的配合物可能为平面结构,[Cu(NH3)4]2+为平面正方形结构,故C错误;
D.[Cu(NH3)2]2+中心原子的配位数是2,中心原子采用sp杂化,导致它们的空间构型为直线型,故D正确;
故选C.
 ,所以当中心原子的配位数为6时,配合单元常呈八面体空间结构,故A正确;
,所以当中心原子的配位数为6时,配合单元常呈八面体空间结构,故A正确;B.[Ag(NH3)2]+中Ag+空的5S轨道和5P轨道以sp杂化成键,所以其空间构型为直线型结构,故B正确;
C.配位数为4的配合物可能为平面结构,[Cu(NH3)4]2+为平面正方形结构,故C错误;
D.[Cu(NH3)2]2+中心原子的配位数是2,中心原子采用sp杂化,导致它们的空间构型为直线型,故D正确;
故选C.
点评:本题考查了微粒的空间构型及原子杂化方式,会根据价层电子对理论分析微粒空间构型及原子杂化方式,熟悉教材中的基础知识,灵活运用这些知识解答问题,
常见杂化方式
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体).
常见杂化方式
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体).

练习册系列答案
相关题目
下列说法中错误的是( )
| A、NH3比PH3稳定 | B、S2- 的离子半径比Cl-离子半径大 | C、第3周期元素中,金属性最强的是Na,非金属性最强的是Cl | D、第ⅡA元素中,Be是化学性质最活泼的金属元素 |
关于甲醛的下列说法中错误的是( )
| A、甲醛是最简单的一种醛,易溶解于水 | B、甲醛是一种无色、有刺激性气味的气体 | C、35%-40%甲醛的水溶液被称之为福尔马林(formalin) | D、福尔马林有杀菌、防腐性能,所以市场上可原来浸泡海产品等 |
 某同学在实验室进行了如图所示的实验,下列说法中错误的是( )
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )