题目内容
向Na2CO3溶液中逐滴加入水杨酸(  )溶液,可能发生的反应的离子方程式且书写正确的是
)溶液,可能发生的反应的离子方程式且书写正确的是
- A.
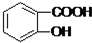 +CO32-→
+CO32-→ +HCO3-
+HCO3- - B.
 +CO32-→
+CO32-→ +HCO3-
+HCO3- - C.2
 +CO32-→2
+CO32-→2 +CO2↑
+CO2↑ - D.3
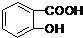 +2CO32-→3
+2CO32-→3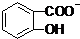 +HCO3-+H2O+CO2↑
+HCO3-+H2O+CO2↑
BD
分析:酸性强弱顺序是羧基>碳酸>酚羟基>HCO3-的,所以水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,最后在和酚羟基反应.如果水杨酸过量,还会生成CO2气体.
解答:A、羧基酸性大于酚羟基,先发生羧基与碳酸钠的反应,故A错误;
B、羧基酸性大于酚羟基,酚羟基酸性强于碳酸氢钠,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,故B正确;
C、滴入过程中,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,再和酚羟基反应,后继续加入会反应生成二氧化碳,故C错误;
D、滴入过程中,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,再和酚羟基反应,后继续加入会反应生成二氧化碳,故D正确;
故选BD.
点评:本题考查水杨酸和碳酸钠反应的有关判断,该题的关键是明确酸性的强弱顺序,如何灵活运用即可.有利于培养学生严谨的逻辑推理能力和抽象思维能力,提高学生的答题效率.
分析:酸性强弱顺序是羧基>碳酸>酚羟基>HCO3-的,所以水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,最后在和酚羟基反应.如果水杨酸过量,还会生成CO2气体.
解答:A、羧基酸性大于酚羟基,先发生羧基与碳酸钠的反应,故A错误;
B、羧基酸性大于酚羟基,酚羟基酸性强于碳酸氢钠,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,故B正确;
C、滴入过程中,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,再和酚羟基反应,后继续加入会反应生成二氧化碳,故C错误;
D、滴入过程中,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,再和酚羟基反应,后继续加入会反应生成二氧化碳,故D正确;
故选BD.
点评:本题考查水杨酸和碳酸钠反应的有关判断,该题的关键是明确酸性的强弱顺序,如何灵活运用即可.有利于培养学生严谨的逻辑推理能力和抽象思维能力,提高学生的答题效率.

练习册系列答案
相关题目
根据下表提供的数据,判断下列离子方程式或化学方程式正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3 | K1=3×10-3 |
| K2=3×10-11 |
| A、向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O=2Cl-+2HClO+CO2 |
| B、向NaHCO3溶液中滴加少量氯水:2HCO3-+CI2=CI-+CIO-+2CO2+H2O |
| C、向NaClO溶液中通入少量CO2:CO2+NaClO+H2O=NaHCO3+HClO |
| D、向NaClO溶液通入足量CO2:CO2+2NaClO+H2O=Na2CO3+2HClO |