题目内容
【题目】如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验.试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色).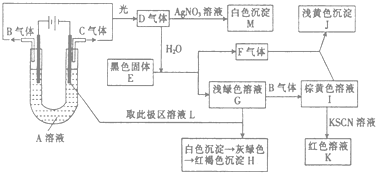
(1)A的化学式为 , E的名称为 .
(2)I和F反应的离子方程式是 .
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是 , 阳极的电极反应式为 , 阴极的电极反应式为 , 电解的化学方程式为 .
【答案】
(1)KCl;硫化亚铁
(2)2Fe3++H2S=2Fe2++S↓+2H+
(3)产生了白色絮状沉淀;Fe﹣2e﹣═Fe2+;2H++2e﹣═H2↑;Fe+2H2O ![]() Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
【解析】解:电解质A的水溶液焰色反应呈浅紫色,由此可知电解质A含有钾元素;二价铁离子显浅绿色,所以G含二价铁离子,G和L反应生成H,根据实验现象知,H 是氢氧化铁,所以溶液L含氢氧根离子,即电解A后,电解液中含有氢氧根离子;C和G反应生成I,I和硫氰化钾反应生成红色溶液K,三价铁离子显黄色,所以I含三价铁离子,二价铁离子和C反应生成三价铁离子,所以C是氯气,I是氯化铁溶液,G是氯化亚铁溶液,所以A是氯化钾;电解氯化钾溶液时,生成物是氯气、氢气和氢氧化钾,所以B是氢气,L是氢氧化钾溶液;B和C光照生成D,氢气和氯气光照生成氯化氢,所以D是氯化氢;氯化氢溶于水得盐酸,盐酸和硝酸银反应生成白色沉淀氯化银,所以M是氯化银;黑色固体E和盐酸反应生成硫化亚铁和气体F,F和氯化铁反应生成淡黄色沉淀J,淡黄色固体有过氧化钠、硫、和溴化银;过氧化钠在溶液中不存在,所以不是过氧化钠,氯化铁和气体不能生成溴化银,所以淡黄色沉淀是硫,黑色固体是硫化亚铁,气体F是硫化氢气体.(1)通过以上分析知,A为KCl;E是硫化亚铁.故答案为:KCl;硫化亚铁;(2)通过以上分析知,I是氯化铁溶液,F是硫化氢,氯化铁有氧化性,硫化氢有还原性,所以氯化铁和硫化氢能发生氧化还原反应生成氯化亚铁和硫单质、盐酸,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ . 故答案为:2Fe3++H2S=2Fe2++S↓+2H+;(3)若将电解装置中的阳极换成铁棒,此时阳极是活泼电极,发生金属铁失电子的氧化反应,即Fe﹣2e﹣═Fe2+ , 阴极上是氢离子得电子的还原反应,即2H++2e﹣═H2↑,溶液的碱性增强,会和亚铁离子结合产生白色沉淀氢氧化亚铁,则在U型管底部可观察到产生了白色絮状沉淀,总反应为:Fe+2H2O ![]() Fe(OH)2↓+H2↑,故答案为:产生了白色絮状沉淀;Fe﹣2e﹣═Fe2+;2H++2e﹣═H2↑;Fe+2H2O
Fe(OH)2↓+H2↑,故答案为:产生了白色絮状沉淀;Fe﹣2e﹣═Fe2+;2H++2e﹣═H2↑;Fe+2H2O ![]() Fe(OH)2↓+H2↑. 电解质A的水溶液焰色反应呈浅紫色,由此可知电解质A含有钾元素;二价铁离子显浅绿色,所以G含二价铁离子,G和L反应生成H,根据实验现象知,H是氢氧化铁,所以溶液L含氢氧根离子,即电解A后,电解液中含有氢氧根离子;C和G反应生成I,I和硫氰化钾反应生成红色溶液K,三价铁离子显黄色,所以I含三价铁离子,二价铁离子和C反应生成三价铁离子,所以C是氯气,I是氯化铁溶液,G是氯化亚铁溶液,所以A是氯化钾;电解氯化钾溶液时,生成物是氯气、氢气和氢氧化钾,所以B是氢气,L是氢氧化钾溶液;B和C光照生成D,氢气和氯气光照生成氯化氢,所以D是氯化氢;氯化氢溶于水得盐酸,盐酸和硝酸银反应生成白色沉淀氯化银,所以M是氯化银;黑色固体E和盐酸反应生成硫化亚铁和气体F,F和氯化铁反应生成淡黄色沉淀J,淡黄色固体有过氧化钠、硫、和溴化银;过氧化钠在溶液中不存在,所以不是过氧化钠,氯化铁和气体不能生成溴化银,所以淡黄色沉淀是硫,黑色固体是硫化亚铁,气体F是硫化氢气体.(1)根据分析写出A的化学式和E的名称;(2)根据硫化氢的还原性和氯化铁的氧化性分析并写出离子方程式,注意气体和单质写化学式;(3)若将电解装置中的阳极换成铁棒,此时阳极是活泼电极,发生金属铁失电子的氧化反应,根据电解池的工作原理来回答.
Fe(OH)2↓+H2↑. 电解质A的水溶液焰色反应呈浅紫色,由此可知电解质A含有钾元素;二价铁离子显浅绿色,所以G含二价铁离子,G和L反应生成H,根据实验现象知,H是氢氧化铁,所以溶液L含氢氧根离子,即电解A后,电解液中含有氢氧根离子;C和G反应生成I,I和硫氰化钾反应生成红色溶液K,三价铁离子显黄色,所以I含三价铁离子,二价铁离子和C反应生成三价铁离子,所以C是氯气,I是氯化铁溶液,G是氯化亚铁溶液,所以A是氯化钾;电解氯化钾溶液时,生成物是氯气、氢气和氢氧化钾,所以B是氢气,L是氢氧化钾溶液;B和C光照生成D,氢气和氯气光照生成氯化氢,所以D是氯化氢;氯化氢溶于水得盐酸,盐酸和硝酸银反应生成白色沉淀氯化银,所以M是氯化银;黑色固体E和盐酸反应生成硫化亚铁和气体F,F和氯化铁反应生成淡黄色沉淀J,淡黄色固体有过氧化钠、硫、和溴化银;过氧化钠在溶液中不存在,所以不是过氧化钠,氯化铁和气体不能生成溴化银,所以淡黄色沉淀是硫,黑色固体是硫化亚铁,气体F是硫化氢气体.(1)根据分析写出A的化学式和E的名称;(2)根据硫化氢的还原性和氯化铁的氧化性分析并写出离子方程式,注意气体和单质写化学式;(3)若将电解装置中的阳极换成铁棒,此时阳极是活泼电极,发生金属铁失电子的氧化反应,根据电解池的工作原理来回答.