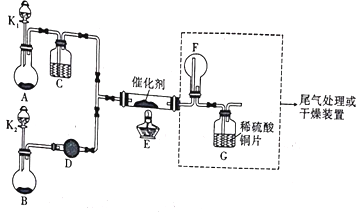
题目内容
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”"
(1)Ti位于周期表的___________(填“s”“p”“d"或“ds")区,写出基态Ti的外围电子排布式:___________。
(2)月球岩石——玄武岩的主要成分为钛酸亚铁( FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。其中SO42-的 VSEPR模型为___________。
(3)TiCl2可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛作催化剂时,可以发生下列聚合反应:nCH3CH=CH2 ![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___________molσ键,与CO互为等电子体的离子是___________(填化学式,写一种)。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,该六棱柱底边边长为c cm,高为a cm,则:

①该晶胞中Ti的配位数为___________。
②该钛晶体的密度为______________________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。
【答案】d 3d24s2 正四面体 sp3、sp2 Cl 10 CN-、C22-或NO+ 12 ![]()
【解析】
由Ti的原子序数22可推知所在区及电子排布式,由VSEPR理论计算相应模型及杂化形式,然后用均摊法及密度公式计算出晶胞密度。
(1)Ti的原子序数22,位于第四周期ⅣB族,属于d区,基态Ti的外围电子排布式为3d24s2;
(2)根据价层电子对互斥理论可知,SO42-的中心原子S原子的价电子对数为4、孤对电子对数=(6+2-4×2)÷2=0,所以SO42-的空间构型为正四面体形;
(3)CH3CH=CH2中左边单键碳原子有4个σ键,无孤电子对,为sp3杂化,中间碳原子有3个σ键,无孤电子对,为sp2杂化;同一周期从左至右,电负性逐渐增大,同一主族从上至下,电负性逐渐减小,故负性最大的是Cl;
(4)1个CO分子中有1个σ键,1个CO分子与Fe形成1个配位键,配位键也是σ键,所以1mol Fe(CO)5含10molσ键;与CO互为等电子体的离子有CN-、C22-或NO+;
(5)该结构为六方最密堆积,配位数为12;1个该晶胞中有6个钛原子,由![]() 。
。