题目内容
已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g)===2H2O(g) ΔH=-Q2 ②
H2O(g)===H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
2H2(g)+O2(g)===2H2O(g) ΔH=-Q2 ②
H2O(g)===H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |
D
试题分析:由盖斯定律得:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-(Q1+2Q3)
2H2(g)+O2(g)===2H2O(l) ΔH=-(Q2+2Q3)
所以4molCH4和1molH2完全燃烧生成液态水放热4Q1+0.5Q2+9Q3。
点评:热化学方程式中,化学计量数表示物质的量。运用盖斯定律对方程式加减时,化学式前面乘以适当的系数,ΔH前也要乘以适当的系数。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,第一次反应达到平衡时共放出热量176.4kJ,此时再向容器中充入2 molSO2和1 molO2,达到新平衡,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,第一次反应达到平衡时共放出热量176.4kJ,此时再向容器中充入2 molSO2和1 molO2,达到新平衡,则下列说法正确的是 FeO(s)+CO(g) △H1=" a" kJ·mol-1
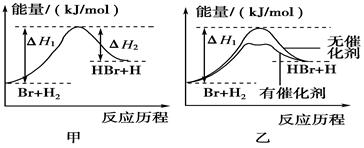
FeO(s)+CO(g) △H1=" a" kJ·mol-1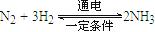 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。