题目内容
制备Fe3O4纳米颗粒的总反应如下:3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是
| A.当转移1mol电子时,消耗56g S2O32- |
| B.在反应中硫元素被氧化,铁元素被还原 |
| C.还原剂是Fe2+,氧化剂是S2O32-和O2 |
| D.每生成1mol Fe3O4,转移3mol电子 |
A
解析试题分析:反应中两个亚铁离子的化合价由+2价升至+3价(Fe3O4中有两个+3价铁), S2O32-中的四个硫全部转变为S4O62-,总体化合价由+8价升至+10价,升高2价,共升高四价;而氧气中氧元素由0价降至—2价,降低四价,反应中有四个电子的转移,所以还原剂为Fe2+、2S2O32-,氧化剂为O2。A.当转移1mol电子时,消耗0.5molS2O32- 即56g。B.在反应中硫、铁元素都被氧化。C.还原剂是Fe2+和S2O32-,氧化剂是和O2 。D.每生成1mol Fe3O4,转移4mol电子,错误。
考点:本题考查氧化还原反应的概念。

 一课一练课时达标系列答案
一课一练课时达标系列答案新型陶瓷材料氮化硅(Si3 N4)可以通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO,下列就该反应的分析错误的是
Si3N4+6CO,下列就该反应的分析错误的是
| A.压强增大,平衡向逆反应方向移动 |
| B.SiO2是氧化剂,CO是氧化产物 |
| C.上述反应若为放热反应,升高温度,平衡常数将减小 |
| D.上述反应中每生成1 molSi3N4,氮元素得12mol电子 |
硝酸盐不稳定,一般受热分解会放出氧气,下列硝酸盐分解可能不会产生氧气的是
| A.硝酸钠 | B.硝酸亚铁 | C.硝酸铵 | D.硝酸铜 |
一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L, 测得反应后溶液中的c(H+)=0.1mol/L。若反应前后溶液体积变化忽略不计,则下列有关判断错误的是
| A.反应后溶液中无硝酸亚铁 |
B.反应前HNO3溶液的浓度为2.0mol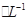 |
C.反应后溶液中c(NO3-)=1.6mol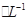 |
| D.反应后的溶液最多还能溶解1.6lgFe |
将KClO3、I2各0.02 mol加入12 g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发)。将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),将过滤后的溶液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气。则A的化学式可能是
| A.IClO | B.ICl3 | C.I2Cl6 | D.KIO3 |
下列变化中,需加氧化剂才能实现的是
| A.NaClO →NaCl | B.Na2O2 → O2 | C.C → CO2 | D.CaO→Ca(OH)2 |
NaClO2可用作造纸的漂白剂,它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2制得,下列说法正确的是
| A.H2O2是氧化剂,H2O2中的氧元素被还原 |
| B.每生成1 mol O2转移的电子的物质的量为4 mol |
| C.ClO2中的氯元素被氧化 |
| D.ClO2是氧化剂,H2O2是还原剂 |
下列叙述正确的是( )。
| A.阳离子只有氧化性,阴离子只有还原性 |
| B.含氧酸可作氧化剂而无氧酸不能 |
| C.在8NH3+3Cl2=N2+6NH4Cl反应中氧化剂与还原剂物质的量之比是2∶3 |
| D.已知还原性:Fe2+>Br-,可知反应2Fe3++2Br-=2Fe2++Br2不易进行 |
已知离子方程式:As2S3+H2O+NO3—―→AsO43—+SO42—+NO↑+______K(未配平),下列说法错误的是( )。
| A.配平后水的化学计量数为4 |
| B.反应后溶液呈酸性 |
| C.配平后氧化剂与还原剂的物质的量之比为3∶28 |
| D.氧化产物为AsO43—和SO42— |