题目内容
下列分子中所有原子都满足最外层8电子结构的是( )
①CO2,②NO2,③PCl3,④PCl5,⑤BeCl2,⑥N2.
①CO2,②NO2,③PCl3,④PCl5,⑤BeCl2,⑥N2.
分析:对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断.
解答:解:①CO2中C元素化合价为+4,C原子最外层电子数是4,4+4=8,所以碳原子满足8电子结构,氧元素化合价的绝对值是+2,氧原子最外层电子数是6,2+6=8,所以氧原子满足8电子结构;
②NO2中N元素化合价为+4价,N原子最外层电子数是5,4+5=9,所以氮原子不满足8电子结构;
③PCl3中P元素化合价为+3价,P原子最外层电子数是5,3+5=8,则P原子满足8电子结构,Cl元素化合价绝对值为1,其最外层电子数是7,1+7=8,则Cl原子满足8电子结构;
④PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构;
⑤BeCl2中Be原子化合价为+2价,Be原子最外层电子数是2,2+2=4,所以Be原子不满足8电子结构;
⑥N2中氮原子之间存在共价三键且每个电子含有1个孤电子对,所以满足8电子结构,
故选B.
②NO2中N元素化合价为+4价,N原子最外层电子数是5,4+5=9,所以氮原子不满足8电子结构;
③PCl3中P元素化合价为+3价,P原子最外层电子数是5,3+5=8,则P原子满足8电子结构,Cl元素化合价绝对值为1,其最外层电子数是7,1+7=8,则Cl原子满足8电子结构;
④PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构;
⑤BeCl2中Be原子化合价为+2价,Be原子最外层电子数是2,2+2=4,所以Be原子不满足8电子结构;
⑥N2中氮原子之间存在共价三键且每个电子含有1个孤电子对,所以满足8电子结构,
故选B.
点评:本题考查了8电子结构的判断,可以根据元素化合价的绝对值与其最外层电子数的和来分析解答,难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
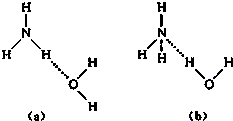 完成下列各题
完成下列各题 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是