题目内容
电子计算器所用的纽扣电池中,还原剂是锌,氧化剂是Ag2O,电解质溶液为KOH溶液;其电极反应如下.Zn-2e-+2OH-═ZnO+H2O,Ag2O+2e-+H2O═2Ag+2OH-.
下列叙述正确的是( )
下列叙述正确的是( )
分析:根据化合价变化可知Zn被氧化,发生氧化反应,应为原电池的负极,则正极为Ag2O,得电子发生还原反应;从总反应方程式分析,氢氧根离子的物质的量没变化但溶剂的量减少,所以碱性增大;电池工作时电子由负极通过外电路流向正极,由电荷守恒可知,带负电荷的阴离子应该移向负极,带正电荷的离子移向正极.
解答:解:A、根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,故A错误;
B、原电池工作时,负发生反应Zn+2OH--2e-=ZnO+H2O,溶液pH值减小,故B错误;
C、根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,故C正确;
D、原电池工作时,正发生反应Ag2O+H2O+2e-=2Ag+2OH-,该极区溶液pH值增大,故D错误.
故选C.
B、原电池工作时,负发生反应Zn+2OH--2e-=ZnO+H2O,溶液pH值减小,故B错误;
C、根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,故C正确;
D、原电池工作时,正发生反应Ag2O+H2O+2e-=2Ag+2OH-,该极区溶液pH值增大,故D错误.
故选C.
点评:本题考查原电池知识,题目难度不大,可以根据所学知识来回答.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
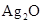 ,电解质溶液为KOH溶液;其电极反应分别是:
,电解质溶液为KOH溶液;其电极反应分别是: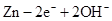 ══
══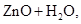
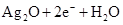 ══
══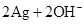 。下列叙述正确的是( )
。下列叙述正确的是( )