题目内容
5. A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.(1)试判断A、B、C、D四种元素的名称.
A氢,B氧,C碳,D钠.
(2)由B、D两种单质生成D2B2的方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2.
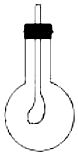
(3)如图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到烧瓶内气球胀大,原因是CO2和NaOH溶液充分接触,发生反应:2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大.
分析 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子,则A为H元素;B是地壳中含量最多的元素,则B为O元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,则C为碳元素;D+具有与Ne原子相同的电子层结构,则D为Na,据此进行解答.
解答 解:A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子,则A为H元素;B是地壳中含量最多的元素,则B为O元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,则C为碳元素;D+具有与Ne原子相同的电子层结构,则D为Na,
(1)由上述分析可知,A为氢元素、B为氧元素、C为碳元素、D为钠元素,
故答案为:氢;氧;碳;钠;
(2)D2B2为Na2O2,钠与氧气加热反应生成Na2O2,反应方程式为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
故答案为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;
(3)在烧瓶中收集满CO2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞,迅速倒入浓的NaOH溶液后,立即塞紧胶塞振荡,CO2和NaOH溶液充分接触,发生反应2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大,
故答案为:烧瓶内气球胀大;CO2和NaOH溶液充分接触,发生反应:2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

| A. | 向苯酚浊液中滴加少量饱和Na2CO3溶液,浊液变澄清,证明结合质子的能力:CO32->C6H5O- | |
| B. | 配制Fe(NO3)2溶液时加入适量的硝酸,可抑制Fe2+水解 | |
| C. | 测定相同温度下相同浓度的碳酸钠和亚硫酸钠溶液的pH,前者大于后者,证明元素的非金属性:C<S | |
| D. | 用激光笔照射蛋白质溶液、硅酸溶胶,可将二者区分开 |
| A. | 3,3-甲基-1-丁烯 | B. | 2,2-二甲基丁烷 | ||
| C. | 2-乙基-1-丁烯 | D. | 2,3,3-三甲基丁烷 |
| A. | 从海水中提取溴,富集溴可以用亚硫酸钠溶液或二氧化硫水溶液作为吸收液 | |
| B. | 从海水中提取碘常用过氧化氢做还原剂 | |
| C. | NaHSO4电离时生成的阳离子有氢离子,所以是酸 | |
| D. | 浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| A. | 可通过酸性高锰酸钾溶液来区别烯烃和炔烃 | |
| B. | 乙烯是石油裂解后的产物 | |
| C. | 芳香烃主要来自于煤的干馏后的煤焦油 | |
| D. | 汽油、煤油、柴油主要来自于石油的常压蒸馏 |
| A. | CaCl2 Na2O H2O | B. | H2O Na2O2 CO2 | ||
| C. | MgCl2 NaOH NH4Cl | D. | H2SO4 H2O CO2 |
| A. | 丁烯、丙烷 | B. | 乙炔、乙烯 | C. | 乙炔、丙烷 | D. | 乙烷、丙烷 |