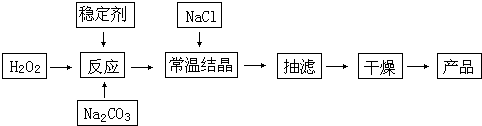
题目内容
下列物质的工业制备的反应原理错误的是( )A.制盐酸:H2+Cl2
 2HCl
2HClB.冶炼铁:Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2C.制漂粉精:2Ca(OH)2+2Cl2→Ca(ClO)2+CaCl2+2H2O
D.制乙烯:C2H5OH
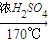 CH2=CH2↑+H2O
CH2=CH2↑+H2O
【答案】分析:A.工业盐酸是用Cl2、H2燃烧法制取;
B.工业上铁的冶炼是在高炉中用一氧化碳还原氧化铁来实现的;
C.工业制漂白精是将氯气通入消石灰溶液中;
D.石油裂解可得到乙烯.
解答:解:A.工业盐酸是用Cl2、H2燃烧法制取HCl气体,然后将HCl气体溶于水制得的,故A正确;
B.工业上铁的冶炼是在高炉中用一氧化碳还原氧化铁来实现的,故B正确;
C.工业制漂白精是将氯气通入消石灰溶液中,主要成分是Ca(ClO)2和CaCl2的混合物但有效成分为CaClO2,故C正确;
D.工业制乙烯是由石油化工裂解而成,故D错误.
故选D.
点评:本题考查物质的工业制备的反应原理,难度不大,平时注意知识的积累.
B.工业上铁的冶炼是在高炉中用一氧化碳还原氧化铁来实现的;
C.工业制漂白精是将氯气通入消石灰溶液中;
D.石油裂解可得到乙烯.
解答:解:A.工业盐酸是用Cl2、H2燃烧法制取HCl气体,然后将HCl气体溶于水制得的,故A正确;
B.工业上铁的冶炼是在高炉中用一氧化碳还原氧化铁来实现的,故B正确;
C.工业制漂白精是将氯气通入消石灰溶液中,主要成分是Ca(ClO)2和CaCl2的混合物但有效成分为CaClO2,故C正确;
D.工业制乙烯是由石油化工裂解而成,故D错误.
故选D.
点评:本题考查物质的工业制备的反应原理,难度不大,平时注意知识的积累.

练习册系列答案
相关题目
下列物质的工业制备原理不正确的是( )
A、氨气:N2+3H2
| ||||
B、硅:SiO2+2C
| ||||
C、乙烯:2C2H5OH
| ||||
| D、漂白粉:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O |