题目内容
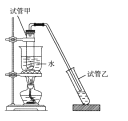
【题目】硫氰化钾可用于农药、医药、电镀、化学试剂、检定铁离子、铜和银等。某兴趣小组同学在实验室模拟工业制备硫氰化钾(KSCN),实验装置如图所示。
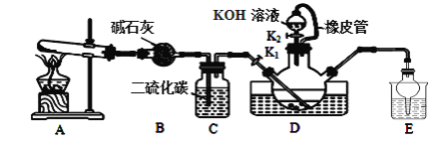
实验步骤如下:
(1)制备NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2。
NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2。
①实验前,应进行的操作是__;三颈烧瓶内盛放有一定量的CS2、水和催化剂。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是__。
②实验开始时打开K1,加热装置A、D,缓慢地向装置D中充入气体。装置A中发生反应的化学方程式是__,装置C的作用可能是__。
(2)制备KSCN溶液:移去装置A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是__。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,___,得到硫氰化钾晶体。
(4)测定KSCN的含量:称取10.00g样品配成1000mL溶液,量取25.00mL溶液于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000mol·L-1AgNO3标准溶液滴定。经过3次平行试验,达到滴定终点时,消耗AgNO3标准溶液的体积平均为20.00mL。滴定反应的离子方程式为SCN-+Ag+=AgSCN↓。
①判断达到滴定终点的方法是__。
②样品中KSCN的质量分数为__(KSCN的摩尔质量为97g·mol-1,保留4位有效数字)。
【答案】检查装置的气密性 使反应物充分接触,防止发生倒吸 2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O 通观察C中产生气泡的流速,便于控制装置A的加热温度 KOH+NH4SCN
CaCl2+2NH3↑+2H2O 通观察C中产生气泡的流速,便于控制装置A的加热温度 KOH+NH4SCN![]() KSCN+NH3↑+H2O 过滤、洗涤、干燥 当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 77.60%
KSCN+NH3↑+H2O 过滤、洗涤、干燥 当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 77.60%
【解析】
(1)①气体的制备或有气体参与的反应,一般需要装置有良好的气密性;氨气易溶于水,要防倒吸;
②CS2和NH3在催化剂作用下加热生成NH4SCN和H2S;该反应需要NH3,则装置A为氨气发生装置;
(2)在装置C中发生反应获得NH4SCN,装置D耐碱分液漏斗中装入的KOH与NH4SCN反应生成KSCN;
(3)从溶液中获取KSCN晶体,常用冷却结晶;
(4)①滴定时发生的离子反应为SCN﹣+Ag+=AgSCN↓,以Fe(NO3)3为指示剂,SCN﹣与Fe3+反应时溶液呈红色,滴定结束时溶液红色消失,检查判断滴定终点现象;
②20.00mL 0.1000mol/LAgNO3标准溶液滴定,n(Ag+)=0.1000mol/L×0.02L=0.002mol,根据SCN﹣+Ag+=AgSCN↓可知,25.00mL待测液中n(SCN﹣)=0.002mol,1000mL待测液中n(SCN﹣)=0.002mol×![]() =0.08mol,结合m=nM计算KSCN的质量分数。
=0.08mol,结合m=nM计算KSCN的质量分数。
(1)①连接好装置后,必须确保装置气密性良好,则实验前需要是检查装置气密性;根据相似相容原理,氨气易溶于水、不溶于二硫化碳,为了使反应物充分接触,防止发生倒吸,所以三颈烧瓶的下层CS2液体必须浸没导气管口;
②制备 NH4SCN溶液的反应为CS2+2NH3 ![]() NH4SCN+H2S,该反应需要NH3,则装置A为氨气发生装置,实验室通过加热NH4Cl固体和Ca(OH)2固体制取氨气,方程式为2NH4Cl+Ca(OH)2
NH4SCN+H2S,该反应需要NH3,则装置A为氨气发生装置,实验室通过加热NH4Cl固体和Ca(OH)2固体制取氨气,方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O,装置C盛放的二硫化碳,作用是观察C中产生气泡的流速,便于控制装置A的加热温度;
CaCl2+2NH3↑+2H2O,装置C盛放的二硫化碳,作用是观察C中产生气泡的流速,便于控制装置A的加热温度;
(2)在装置C中发生反应获得NH4SCN,装置D耐碱分液漏斗中装入的KOH与NH4SCN反应生成KSCN,反应方程式为KOH+NH4SCN![]() KSCN+NH3↑+H2O;
KSCN+NH3↑+H2O;
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,过滤,干燥,得到硫氰化钾晶体;
(4)①滴定时发生的离子反应为SCN﹣+Ag+=AgSCN↓,以Fe(NO3)3为指示剂,SCN﹣与Fe3+反应时溶液呈红色,所以滴定终点现象为:当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复;
②20.00mL 0.1000mol/LAgNO3标准溶液滴定,n(Ag+)=0.1000mol/L×0.02L=0.002mol,根据SCN﹣+Ag+=AgSCN↓可知,25.00mL待测液中n(SCN﹣)=0.002mol,1000mL待测液中n(SCN﹣)=0.002mol×![]() =0.08mol,则KSCN的质量分数为
=0.08mol,则KSCN的质量分数为![]() ×100%=77.60%。
×100%=77.60%。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案