题目内容
能正确表示下列反应的离子方程式为( )。
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C.硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
B
选项A,NaHCO3溶液与Ca(OH)2溶液反应一定生成CaCO3;选项B,在溶液中ClO-能将SO2氧化为SO42-;选项C,BaS与稀硫酸反应生成更难溶的BaSO4沉淀;选项D,在强碱溶液中,不可能生成H+。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
|
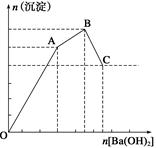
(16分)粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:  请回答下列问题: (1)操作i所需要的玻璃仪器有: (填序号)。 a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗 (2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。 (3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。 (4)写出生成固体H的离子方程式 。 (5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量: ①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是 (请用化学方程式表示)。 ②判断滴定终点的现象为 。 ③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是 (请用离子方程式及简单的文字描述)。 |
 CO32-+H3O+
CO32-+H3O+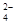 +4H+
+4H+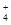
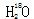 中投入Na2O2固体:
中投入Na2O2固体: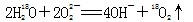
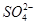 完全沉淀:Al3++2
完全沉淀:Al3++2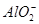 +2BaSO4↓+2H2O
+2BaSO4↓+2H2O H3O+ + CO32-
H3O+ + CO32- CH3COOH + NH3·H2O
CH3COOH + NH3·H2O CaCO3(s) + SO42-(aq)
CaCO3(s) + SO42-(aq)