题目内容
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。
(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。

(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
(1)
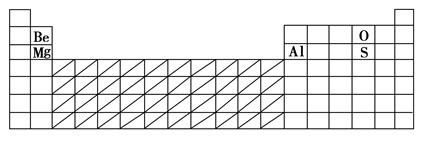
(2)见上表 (3)O2-
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)BeO+2OH-=BeO22-+H2O

(2)见上表 (3)O2-
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)BeO+2OH-=BeO22-+H2O
(1)根据表格提供数据,可以推断D为Be,A为Mg,E为O,C为S,B为Al。(2)根据元素周期律,在过渡元素区域寻找催化剂材料。(3)根据具有相同电子层结构的不同微粒,核电荷数越大,微粒半径越小,Mg2+、Al3+、O2-中半径最大的为O2-。(4)Al与Mg在化学性质上明显不同的是Al能与强碱溶液反应。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目