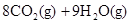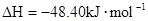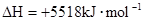题目内容
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(KJ)是( )


| A.194 | B.516 | C.391 | D.658 |
C
反应热就是断键吸收的能量和形成化学键所放出的能量的差值。根据图像可知,1mol肼和1mol氧气转化为原子时吸收的能量应该是2752kJ-534kJ=2218kJ,所以一定有4x+154kJ/mol+500kJ/mol=2218kJ/mol,解得x=391kJ/mol,答案选C。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 ΔH=-38.6 kJ·mol-1
ΔH=-38.6 kJ·mol-1 2NH3(g), △H="-92.4" kJ·mol—1,则H—H键的键能是( )
2NH3(g), △H="-92.4" kJ·mol—1,则H—H键的键能是( )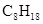 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )