题目内容
世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全杀菌消毒剂,ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用.
(1)实验室制备ClO2的方法之一为:
2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O (H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是______.
2ClO2↑+K2SO4+2CO2↑+2H2O (H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是______.
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1mol KClO3参加反应有2mol电子转移
(2)KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯.其变化可表示为2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.浓盐酸在反应中表现出来的性质是______.
解:(1)反应2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,
2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,
A、KClO3中Cl元素的化合价由+5价降低为+4价,则在反应中得到电子,故A正确;
B、H2C2O4中C元素的化合价由+3价升高到+4价,草酸为还原剂,在反应中被氧化,则CO2为氧化产物,故B错误;
C、H2C2O4中C元素的化合价由+3价升高到+4价,草酸为还原剂,在反应中被氧化,故C正确;
D、1molKClO3参加反应转移电子为1mol×(5-4)=1mol,故D错误;
故答案为:AC;
(2)由反应2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O可知,生成KCl时表现盐酸的酸性,生成Cl2时Cl元素的化合价由-1价升高到0,则表现HCl的还原性,
故答案为:酸性和还原性.
分析:(1)根据氧化还原反应中元素的化合价变化分析,含元素化合价升高的物质为还原剂,在反应中被氧化,对应的产物为氧化产物;含元素化合价降低的物质为氧化剂,在反应中得电子被还原,对应的产物为还原产物,并利用化合价的变化来分析电子转移的数目;
(2)根据反应,生成盐时表现酸的酸性,HCl中Cl元素的化合价升高表现为还原性.
点评:本题考查氧化还原反应,明确元素的化合价变化是解答本题的关系,学生应熟悉常见元素的化合价及化合物中元素的化合价计算来解答.
 2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,
2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,A、KClO3中Cl元素的化合价由+5价降低为+4价,则在反应中得到电子,故A正确;
B、H2C2O4中C元素的化合价由+3价升高到+4价,草酸为还原剂,在反应中被氧化,则CO2为氧化产物,故B错误;
C、H2C2O4中C元素的化合价由+3价升高到+4价,草酸为还原剂,在反应中被氧化,故C正确;
D、1molKClO3参加反应转移电子为1mol×(5-4)=1mol,故D错误;
故答案为:AC;
(2)由反应2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O可知,生成KCl时表现盐酸的酸性,生成Cl2时Cl元素的化合价由-1价升高到0,则表现HCl的还原性,
故答案为:酸性和还原性.
分析:(1)根据氧化还原反应中元素的化合价变化分析,含元素化合价升高的物质为还原剂,在反应中被氧化,对应的产物为氧化产物;含元素化合价降低的物质为氧化剂,在反应中得电子被还原,对应的产物为还原产物,并利用化合价的变化来分析电子转移的数目;
(2)根据反应,生成盐时表现酸的酸性,HCl中Cl元素的化合价升高表现为还原性.
点评:本题考查氧化还原反应,明确元素的化合价变化是解答本题的关系,学生应熟悉常见元素的化合价及化合物中元素的化合价计算来解答.

练习册系列答案
相关题目
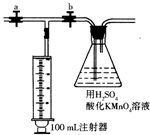
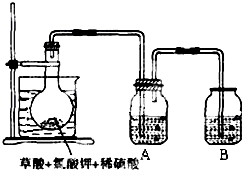 二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂.常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定.温度过高,二氧化氯的水溶液有可能爆炸.某研究小组设计如图所示实验制备ClO2.
二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂.常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定.温度过高,二氧化氯的水溶液有可能爆炸.某研究小组设计如图所示实验制备ClO2.