题目内容
【题目】如图图示与对应的叙述相符的是( ) 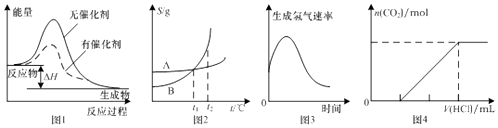
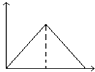
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
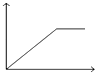
B.图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
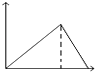
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
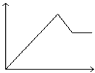
D.图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 molL﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系
【答案】AC
【解析】解:A.加入催化剂,可降低反应的活化能,图象符合,故A正确;B.t1℃时A、B的饱和溶液质量分数相等,升高温度,溶解度增大,但质量分数不变,则溶质的质量分数B=A,故B错误;
C.开始时反应放热温度升高,则反应速率加快,随着反应进行浓度减小,则速率减小,故C正确;
D.碳酸钠先和盐酸反应生成碳酸氢钠,如分别为NaOH、Na2CO31mol,则生成气体时消耗2molHCl,最后生成1mol二氧化碳,则图象中生成二氧化碳前后消耗的盐酸体积比为2:1,故D错误.
故选AC.
【考点精析】本题主要考查了反应热和焓变的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热才能正确解答此题.

【题目】将 ![]() 转变为
转变为 ![]() 的方法为( )
的方法为( )
A.溶液加热,通入足量的HCl
B.与足量的NaOH溶液共热后,再通入CO2
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
(1)合成苯甲酸甲酯粗产品 (i)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用(填“甲”或“乙”)装置.理由是 . 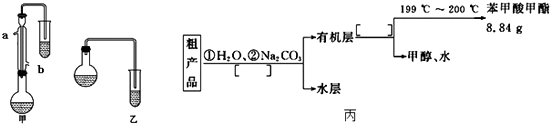
(ii)实验中浓硫酸的作用是冷凝水应从(填“a”或“b”,下同)口进,口出.
(iii)反应物CH3OH应过量,理由是;两套装置中导管末端均没有伸入到试管液面以下的原因 .
(2)粗产品的精制 苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图丙中方括号内填入操作方法的名称.