题目内容
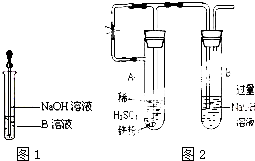
5.实验室中有一瓶氯化钾和氯化钙的固体混和物,通过下面的实验可确定该混和物中氯化钾和氯化钙的质量比,也可制得纯净的氯化钾.根据实验步骤填写下列空白.
(1)调整零点时,若指针偏向左边,应将左边的螺丝帽向(填左、右)右旋动.
(2)某学生用已知质量Y g的表面皿,为了准确称取W g样品.他在托盘天平的右盘上放入(W+Y)g砝码,在左盘的表面皿中加入样品,这时指针偏向右边(如图1所示),下面他的操作应该是小心加入药品,使指针指向刻度中央.

(3)加入的A是K2CO3,检验A是否过量的方法是取上层澄清溶液少许,加盐酸观察是否有无色气体生成.
(4)过滤时,某学生的操作如图2,请用文字说明图中的错误是玻璃棒没有靠三层滤纸一侧和漏斗末端尖嘴没有紧靠烧杯内壁(写两处即可).
(5)滤液中加入的B物质是稀盐酸.应该加入过量的B物质,理由是为防止引入碳酸钾杂质.
(6)为了检验沉淀是否洗净,应在最后几滴滤液中加入硝酸银溶液,若无白色沉淀,表示沉淀已洗净.
(7)得到的固体C是CaCO3.
(8)该混和物中氯化钾与氯化钙质量比的计算式是$\frac{100W-111{W}_{2}}{111{W}_{2}}$.
分析 (1)根据调节平衡时,只可以调节平衡螺母,并且向指针偏向的反方向调节解答;
(2)根据指针的偏转判断物体的轻重,实施相应的操作使指针指向中央;
(3)加入A物质能使氯化钙转化为沉淀又不产生新的杂质来判断A的成分;根据A的化学性质选取相应的试剂判断是否过量;
(4)根据过滤操作的一贴、二低、三靠进行分析解答即可;
(5)滤液中含有碳酸钾,为了制得纯净的氯化钾,应除去碳酸根离子,据此选择合适的试剂;
(6)沉淀是碳酸钙,洗涤液中如果含有阴离子应为氯离子,根据氯离子的检验方法判断是否洗净;
(7)碳酸钾与氯化钙反应生成碳酸钙和氯化钾;
(8)先根据碳酸钙的质量计算氯化钙的质量,总质量减去氯化钙的质量就是氯化钾的质量.
解答 解:(1)调整托盘天平零点时,若指针偏向左边,应将左边的平衡螺母向右旋转,直到指针指在分度盘的中央;
故答案为:右;
(2)指针向右偏转,说明砝码的质量大于物质的质量,所以应小心加入药品,使指针指向刻度中央;
故答案为:小心加入药品,使指针指向刻度中央;
(3)加入A物质,能使氯化钙产生沉淀且不引进新的杂质离子,所以应加入碳酸钾溶液,碳酸钾和氯化钙反应生成碳酸钙沉淀和氯化钾;如果碳酸钾过量,溶液中含有碳酸根离子,碳酸根离子和强酸能发生生成二氧化碳气体,所以检验方法是 取上层澄清溶液少许,加盐酸观察是否有无色气体生成,如果有气体生成就说明过量,否则不过量;
故答案为:K2CO3; 取上层澄清溶液少许,加盐酸观察是否有无色气体生成;
(4)据图可以看出,玻璃棒轻靠三层滤纸一侧,漏斗末端尖嘴没有紧靠烧杯内壁;
故答案为:玻璃棒没有靠三层滤纸一侧;漏斗末端尖嘴没有紧靠烧杯内壁;
(5)滤液中含有碳酸钾,为了制得纯净的氯化钾,应除去碳酸根离子,可以加入足量稀盐酸,稀盐酸与碳酸钾反应生成氯化钾、水和二氧化碳;
故答案为:稀盐酸;为防止引入碳酸钾杂质;
(6)由题意可知:得到的固体是碳酸钙;沉淀上容易沾有氯离子,所以洗涤液中含有氯离子,如果沉淀洗涤干净,洗涤液中就没有氯离子,检验方法是:取最后一次洗出液加入AgNO3溶液,观察是否有白色沉淀析出;
故答案为:硝酸银溶液;无白色沉淀;
(7)碳酸钾与氯化钙反应生成碳酸钙和氯化钾;
所以产生的沉淀C是碳酸钙;
故答案为:CaCO3;
(8)根据钙原子守恒计算氯化钙的质量,设氯化钙的质量为x,
CaCO3----CaCl2
100 111
W2 x
x=$\frac{111{W}_{2}}{100}$;
所以氯化钾的质量为=Wg-$\frac{111{W}_{2}}{100}$;
所以氯化钾和氯化钙的质量比为$\frac{111{W}_{2}}{100}$:(W-$\frac{111{W}_{2}}{100}$)=$\frac{100W-111{W}_{2}}{111{W}_{2}}$;
故答案为:$\frac{100W-111{W}_{2}}{111{W}_{2}}$.
点评 本题考查了实验的基本操作,熟悉托盘天平的使用方法及过滤的注意事项是解题关键,题目难度不大.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. | 好酒不怕巷子深----分子在不断的运动 | |
| B. | 热胀冷缩----温度升高,分子变大 | |
| C. | 给轮胎打气----分子之间有间隔 | |
| D. | 湿衣服在夏天比在冬天干得快----温度升高,分子运动速率加快 |
| A. | 试液最终变为红色 | B. | 试液不变色 | ||
| C. | 试液直接褪为无色 | D. | 试液先变红,后褪色 |
| A. | 由Fe跟S直接化合可得FeS,类推出Cu跟S直接化合可得Cu2S | |
| B. | 金属镁失火不能用CO2灭火,金属钠失火也不能用CO2灭火 | |
| C. | NH4Cl、NH4I结构相似,将两种固体分别加热,分解都只生成卤化氢和氨气 | |
| D. | 原电池中通常是活泼金属做负极,不活泼金属做正极,用镁和铝与NaOH溶液构成原电池时,镁是负极 |

 某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.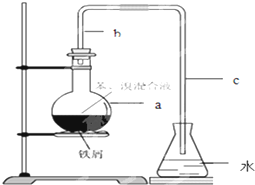 化学课外小组用如图装置制取溴苯.
化学课外小组用如图装置制取溴苯. .
.