题目内容
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是
A.NaCl晶体、BaSO4
B.铜、二氧化硫
C.硫酸溶液、HCl
D.熔融的KNO3、酒精
【答案】D
【解析】
试题分析:A.NaCl和BaSO4是盐类,属于电解质,故A错误;B.铜是单质,既不属于电解质,也不属于非电解质,故B错误;C.硫酸溶液属于混合物,不属于电解质,也不属于非电解质,故C错误;D.熔融的KNO3是盐类,属于电解质,酒精不导电,属于非电解质,故D正确;故选D。

 名校课堂系列答案
名校课堂系列答案【题目】工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
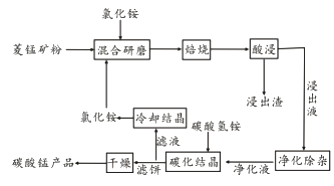
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为____________________。
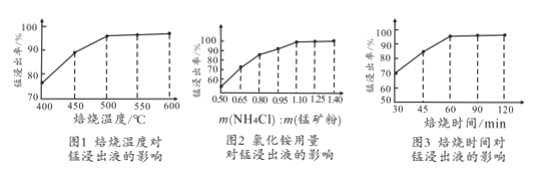
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________、_______________、______________。
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________。
(5)上述流程中可循环使用的物质是_______________。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________(还原产物是Cr3+。
②产品中碳酸锰的质量分数为_____________(结果保留3位有效数字)。
【题目】下列各物质所属类别的判断均正确的一组是( )
混合物 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | 液氨 | 苛性钠 | 胆矾 | 氧化铁 | 二氧化碳 |
B | 纯盐酸 | 烧碱 | 食盐 | 氧化钠 | 二氧化氮 |
C | 8﹒4消毒液 | 纯碱 | 石灰石 | 氨气 | 水 |
D | 聚乙烯塑料 | 熟石灰 | 苏打 | 生石灰 | 二氧化硫 |
A. A B. B C. C D. D


