题目内容
某元素X所形成的分子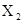 共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是 ( )
共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是 ( )
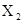 共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是 ( )
共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是 ( )| A.X有三种同位素 |
| B.其中一种同位素的原子质量数为81 |
| C.质量数为79的同位素,其原子质量分数为50% |
D.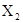 的平均相对分子质量为159 的平均相对分子质量为159 |
B
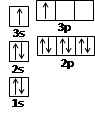
试题分析:根据X元素可以形成3种分子可知,X应该有2种同位素。根据分子的相对分子质量可知,同位素的质量数分别是79和81。又因为三种分子的物质的量之比是7:10:7,所以两种同位素原子的个数之比是1:1的,则质量数为79的同位素,其原子质量分数小于50%,X的平均相对分子质量是80,则分子的平均相对分子质量是160,因此正确的答案选B。
点评:该题是中等难度的试题,试题综合性强,在注重对学生基础性知识考查与训练的同时,侧重对学生能力的培养。该题的关键是借助于数学中的排列组合得出含有2种同位素原子,然后在根据元素相对原子质量的计算依据,并结合题意灵活运用即可,有助于培养学生的逻辑思维能力和抽象思维能力。

练习册系列答案
相关题目
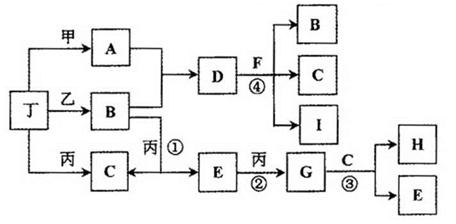
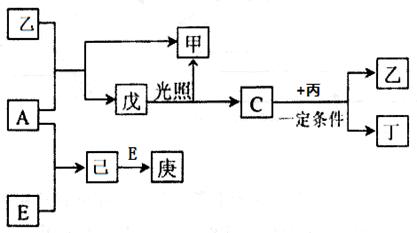
 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。