题目内容
18.用28g氮气和3g氢气在一定条件下发生反应,如果实际产率是理论产率的30%,则可得到的氨气的质量是( )| A. | 17 g | B. | 5.1 g | C. | 10.2 g | D. | 34 g |
分析 n(N2)=$\frac{28g}{28g/mol}$=1mol,n(H2)=$\frac{3g}{2g/mol}$=1.5mol,合成氨反应方程式为N2(g)+3H2(g)?2NH3(g),根据方程式知,1mol氮气完全反应需要氢气3mol>1.5mol,说明氮气过量,根据氢气计算得到氨气质量.
解答 解:n(N2)=$\frac{28g}{28g/mol}$=1mol,n(H2)=$\frac{3g}{2g/mol}$=1.5mol,合成氨反应方程式为N2(g)+3H2(g)?2NH3(g),根据方程式知,1mol氮气完全反应需要氢气3mol>1.5mol,说明氮气过量,如果实际产率是理论产率的30%,根据H原子守恒得氨气质量=$\frac{1.5mol}{3}×2×17g/mol×30%$=5.1g,
故选B.
点评 本题考查化学方程式有关计算,为高频考点,明确氢气与氨气关系是解本题关键,注意要首先进行过量计算,为易错题.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
8.A、B、C、D为短周期元素,且原子序数依次增大.已知A原子的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A. | 非金属性:A>B | |
| B. | 四种元素中,C处于元素周期表中最左、下方,故原子半径最大 | |
| C. | 元素B和C只能形成一种化合物 | |
| D. | A、C、D的最高价氧化物对应的水化物中没有两性氢氧化物 |
6.锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷.我国有丰富的锆英石(ZrSiO4)含Al2O3、SiO2、Fe2O3等杂质,碱熔法生产锆的流程如下:
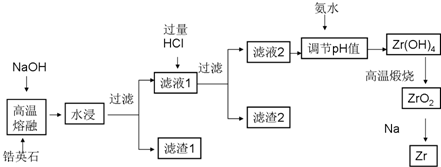
已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)完成高温熔融时的主要反应方程式:
ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O
(2)为了提高浸出率可采取的方法有将原料粉碎增大接触面积、加热或搅拌或多次浸取(列举两种)
(3)生成滤渣2的成分H2SiO3 或 H4SiO4(用化学式表示)
(4)用氨水将滤液2的pH调至2.4≤pH<3.4,目的是使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来.
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入HCl气流中气流同时蒸发结晶,可回收得到铁的氯化物FeCl3晶体.

已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O
(2)为了提高浸出率可采取的方法有将原料粉碎增大接触面积、加热或搅拌或多次浸取(列举两种)
(3)生成滤渣2的成分H2SiO3 或 H4SiO4(用化学式表示)
(4)用氨水将滤液2的pH调至2.4≤pH<3.4,目的是使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来.
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入HCl气流中气流同时蒸发结晶,可回收得到铁的氯化物FeCl3晶体.
13.郴州被称为“中国矿晶之都”、“世界有色金属博物馆”.2015年5月成功举办了第三届中
国(湖南)国际矿物宝石博览会.矿博会上展示了色彩缤纷、形状各异的金属矿物,下
列金的冶炼属于热还原法的是( )
国(湖南)国际矿物宝石博览会.矿博会上展示了色彩缤纷、形状各异的金属矿物,下
列金的冶炼属于热还原法的是( )
| A. | 2NaCl(熔融)=2Na+Cl2↑ | B. | WO3+3H2 $\frac{\underline{\;△\;}}{\;}$ W+3H2O | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2Ag2O $\frac{\underline{\;△\;}}{\;}$4Ag+O2↑ |
4.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
 青霉素是最重要的抗生素.青霉素在人体内经酸性水解后,得到青霉素氨基酸,其结构简式如图所示.
青霉素是最重要的抗生素.青霉素在人体内经酸性水解后,得到青霉素氨基酸,其结构简式如图所示.