��Ŀ����
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ����ʽΪ �� ���÷�Ӧ6NO2+8NH3 ![]() 7N2+12H2OҲ���Դ���NO2 �� ��ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������ L��
7N2+12H2OҲ���Դ���NO2 �� ��ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������ L��
��2����֪��
2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1
2NO ��g��+O2��g��2NO2��g����H=��113.0kJmol��1
��ӦNO2��g��+SO2��g��SO3��g��+NO ��g�� �ġ�H=kJmol��1 �� һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1mol SO3��ͬʱ����1mol NO2
���������Ӧƽ��ʱ��NO2��SO2�����Ϊ1��6����ƽ�ⳣ��K= ��
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO ��g��+2H2��g��CH3OH ��g����
��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ1��ʾ���÷�Ӧ��H0���������������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��
�ڼ״�ȼ�ϵ�أ����DMFC�����ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC����ԭ����ͼ2��ʾ��ͨ��a����ĵ缫��ԭ��ص��������������������缫��ӦʽΪ ��
���𰸡�
��1��3NO2+H2O�T2HNO3+NO��67.2
��2����41.8��b��![]()
��3��������1.3��104kPa�£�CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӵò���ʧ������O2+4e��+4H+=2H2O
���������⣺��1��NO2��H2O��Ӧ�ķ���ʽΪ��3NO2+H2O�T2HNO3+NO��6NO2+8NH3�T7N2+12H2O������Ӧ����1 mol NO2�μӷ�Ӧʱ����ת����4 mol���ӣ���ת��12mol����ʱ�����ĵ�NO2Ϊ12��4��22.4L=67.2L��
���Դ��ǣ�3NO2+H2O�T2HNO3+NO��67.2����2�����ݸ�˹���ɣ����ڶ�������ʽ�ߵ����������һ������ʽ��ӵã�2NO2+2SO2�T2SO3+2NO����H=��83.6 kJmol��1 �� ��NO2+SO2SO3+NO��H=��41.8 kJmol��1��
a������Ӧ�Ƿ�Ӧǰ���������������ķ�Ӧ������ϵ��ѹǿ���ֲ��䣬��a����˵����Ӧ�Ѵﵽƽ��״̬��a����
b�����ŷ�Ӧ�Ľ��У�NO2��Ũ�ȼ�С����ɫ��dz����b����˵����Ӧ�Ѵ�ƽ�⣬��b��ȷ��
c��SO3��NO�����������������1��1����c������Ϊƽ��״̬���ж����ݣ���c����
d��d���������������ʶ����淴Ӧ���ʣ�������Ϊƽ��״̬���ж����ݣ���d����
��ѡb��
NO2��g��+ | SO2��g�� | SO3��g��+ | NO��g�� | ||
��ʼ���ʵ���� | a | 2a | 0 | 0 | |
ת�����ʵ���� | x | x | x | x | |
ƽ�����ʵ���� | a��x | 2a��x | x | x |
ƽ��ʱNO2��SO2�����Ϊ1��6���� ![]() =
= ![]() ����x=
����x= ![]() a����ƽ�ⳣ��K=
a����ƽ�ⳣ��K= ![]() =
= ![]() =
= ![]() =
= ![]() ��
��
���Դ��ǣ���41.8��b�� ![]() ����3���ٴӺ�������һ��0.5������һ��ƽ��������������ߣ�����ͬѹǿ�²�ͬ�¶�ʱCO��ƽ��ת���ʣ��¶�Խ��ת����Խ�ͣ�˵��������ʱƽ���������ƶ���
����3���ٴӺ�������һ��0.5������һ��ƽ��������������ߣ�����ͬѹǿ�²�ͬ�¶�ʱCO��ƽ��ת���ʣ��¶�Խ��ת����Խ�ͣ�˵��������ʱƽ���������ƶ���
�ڶ��ʣ�ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������ǹ�ҵ����Ҫ�����پ���Ч�棬Ҫ�����ٶȺ�Ч�ʣ�ѹǿԽ����Ҫ������Խ�ߣ�����Խ��
���Դ��ǣ�������1.3��104kPa�£�CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӵò���ʧ��
�ڸ���ͼ֪������Ĥ�����ӽ���Ĥ����������Һ�����ԣ������������ƶ�����֪��ͨ��a�ĵ缫Ϊ������ͨ��b�ĵ缫Ϊ�����������ϼ״�ʧȥ���ӷ���������Ӧ��������ӦʽΪ CH3OH��6e��+H2O=CO2+6H+ �� �����������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+4e��+4H+=2H2O��
���Դ��ǣ�����O2+4e��+4H+=2H2O��
�����㾫����������Ĺؼ��������ⷴӦ�Ⱥ��ʱ�����֪ʶ�������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ��Լ��Ի�ѧƽ��״̬���жϵ����⣬�˽�״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�

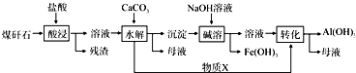
����Ŀ��úȼ���ŷŵ���������SO2��NOx���γ����ꡢ��Ⱦ����������NaClO2��Һ��Ϊ���ռ���ͬʱ���������������������ش��������⣺
��1���ڹ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ 5��103mol��L1����Ӧһ��ʱ�����Һ������Ũ�ȵķ���������±���
���� | SO42�� | SO32�� | NO3�� | NO2�� | Cl�� |
c/��mol��L1�� | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ___________________________________������ѹǿ��NO��ת����______________�����������������������������������
���������շ�Ӧ�Ľ��У����ռ���Һ��pH��______________ ��������������������������С������
����ʵ������֪������Ӧ����______������Ӧ���ʣ���������������С��������ԭ���dz���SO2��NO�������еij�ʼŨ�Ȳ�ͬ����������________________��
��2���ڲ�ͬ�¶��£�NaClO2��Һ���������ķ�Ӧ�У�SO2��NO��ƽ���ѹpc��ͼ��ʾ����ͼ������֪����Ӧ�¶����ߣ�����������Ӧ��ƽ�ⳣ����_________����������������������������С������