题目内容
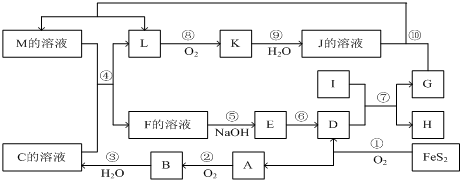
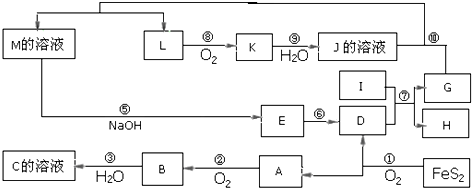
如图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料.

请填写下列空白:
(1)在周期表中,组成单质G的元素的位置:______.
(2)在反应⑨中还原剂与氧化剂的物质的量之比为______.
(3)在反应②.③.⑥.⑧中,既属于化合反应又属于氧化还原反应的是______(填写序号).
(4)反应④的离子方程式是:______
反应⑦的化学反应方程式:______
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.该反应的化学方程式是:______.
解:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,即铝热反应.K是一种红棕色气体,为NO2,则J为HNO3,L被氧化成为NO2,故L可能为氨或NO2,由于C溶液,即硫酸溶液能与某M溶液反应得到L,故L不可能是碱性的气体氨气,故L为NO,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,由反应4FeS2+11O2  2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,
2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,
(1)由以上分析可知G为Fe,是26号元素,位于周期表第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)K是NO2,二氧化氮和水反应的方程式为:3NO2+H2O=2HNO3+NO,作还原剂的二氧化氮计量数是2,作氧化剂的二氧化氮计量数是1,所以该反应中还原剂与氧化剂的物质的量之比2:1,故答案为:2:1;
(3)在反应②.③.⑥.⑧中,②是氧化还原反应和化合反应,③是化合反应但不是氧化还原反应,⑥是分解反应且不是氧化还原反应,⑧是化合反应和氧化还原反应,所以既属于化合反应又属于氧化还原反应的是②.⑧,故答案为:②.⑧;
(4)M中含有Fe2+和NO3-,在酸性条件下可发生氧化还原反应,反应的离子方程式为Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
D是氧化铁,I是铝,高温下,氧化铁和铝反应生成氧化铝和铁,反应方程式为:2Al+Fe2O3 2Fe+Al2O3,
2Fe+Al2O3,
故答案为:Fe2++4H++NO3-=3Fe3++NO↑+2H2O;2Al+Fe2O3 2Fe+Al2O3;
2Fe+Al2O3;
(5)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
分析:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,即铝热反应.K是一种红棕色气体,为NO2,则J为HNO3,L被氧化成为NO2,故L可能为氨或NO2,由于C溶液,即硫酸溶液能与某M溶液反应得到L,故L不可能是碱性的气体氨气,故L为NO,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,由反应4FeS2+11O2 2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,结合对应物质的性质和题目要求解答该题.
2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,结合对应物质的性质和题目要求解答该题.
点评:本题考查无机物的推断,题目难度中等,本题注意根据FeS2与氧气反应的性质结合物质的反应特点和物质的物理性质,如颜色、状态等,先确定个别物质,根据框图寻找线索进行推断.
 2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,
2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,(1)由以上分析可知G为Fe,是26号元素,位于周期表第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)K是NO2,二氧化氮和水反应的方程式为:3NO2+H2O=2HNO3+NO,作还原剂的二氧化氮计量数是2,作氧化剂的二氧化氮计量数是1,所以该反应中还原剂与氧化剂的物质的量之比2:1,故答案为:2:1;
(3)在反应②.③.⑥.⑧中,②是氧化还原反应和化合反应,③是化合反应但不是氧化还原反应,⑥是分解反应且不是氧化还原反应,⑧是化合反应和氧化还原反应,所以既属于化合反应又属于氧化还原反应的是②.⑧,故答案为:②.⑧;
(4)M中含有Fe2+和NO3-,在酸性条件下可发生氧化还原反应,反应的离子方程式为Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
D是氧化铁,I是铝,高温下,氧化铁和铝反应生成氧化铝和铁,反应方程式为:2Al+Fe2O3
 2Fe+Al2O3,
2Fe+Al2O3,故答案为:Fe2++4H++NO3-=3Fe3++NO↑+2H2O;2Al+Fe2O3
 2Fe+Al2O3;
2Fe+Al2O3;(5)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
分析:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,即铝热反应.K是一种红棕色气体,为NO2,则J为HNO3,L被氧化成为NO2,故L可能为氨或NO2,由于C溶液,即硫酸溶液能与某M溶液反应得到L,故L不可能是碱性的气体氨气,故L为NO,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,由反应4FeS2+11O2
 2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,结合对应物质的性质和题目要求解答该题.
2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I为第三主族熔点最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,结合对应物质的性质和题目要求解答该题.点评:本题考查无机物的推断,题目难度中等,本题注意根据FeS2与氧气反应的性质结合物质的反应特点和物质的物理性质,如颜色、状态等,先确定个别物质,根据框图寻找线索进行推断.

练习册系列答案
相关题目