题目内容
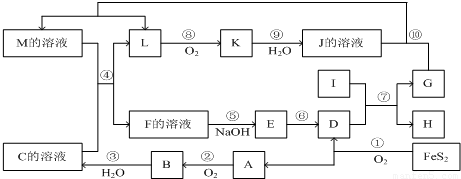
I如图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,K是一种红棕色气体,D的俗名叫铁红,A是形成酸雨的主要气体.

请填写下列空白:
(1)推导出下列物质的化学式:L:
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于氧化还原反应的是
(3)在反应⑨中氧化剂与还原剂的物质的量之比为
(4)反应⑦的化学方程式是:
II硝酸溶液是 一种重要的化工原料,而氨气是工业生产硝酸的重要原料.
①据报道用Mg与石墨作电极与NH4Cl溶液形成原电池,也可生成NH3.其反应是Mg+2NH4Cl=MgCl2+2NH3↑+H2↑,写出该电池正极的电极反应式
②硝酸厂常用碱液吸收法处理尾气:用Na2CO3溶液吸收NO2生成CO2.若每2mol NO2和Na2CO3溶液反应时转移电子1mol,则反应的离子方程式是

请填写下列空白:
(1)推导出下列物质的化学式:L:
NO
NO
,C:H2SO4
H2SO4
,E:Fe(OH)3
Fe(OH)3
;(2)在反应②、③、⑥、⑨中,既属于化合反应又属于氧化还原反应的是
②
②
(填写序号).(3)在反应⑨中氧化剂与还原剂的物质的量之比为
1:2
1:2
.(4)反应⑦的化学方程式是:
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
.
| ||
II硝酸溶液是 一种重要的化工原料,而氨气是工业生产硝酸的重要原料.
①据报道用Mg与石墨作电极与NH4Cl溶液形成原电池,也可生成NH3.其反应是Mg+2NH4Cl=MgCl2+2NH3↑+H2↑,写出该电池正极的电极反应式
2NH4++2e-=2NH3↑+H2↑
2NH4++2e-=2NH3↑+H2↑
.②硝酸厂常用碱液吸收法处理尾气:用Na2CO3溶液吸收NO2生成CO2.若每2mol NO2和Na2CO3溶液反应时转移电子1mol,则反应的离子方程式是
2NO2+CO32-=NO3-+NO2-+CO2
2NO2+CO32-=NO3-+NO2-+CO2
.分析:Ⅰ、I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,可以推断I为Al,K是L和氧气反应生成的一种红棕色气体,判断为NO2,L为NO,J为HNO3;D的俗名叫铁红为Fe2O3,A是形成酸雨的主要气体为SO2,依据I+D=G+H,判断为2Al+Fe2O3=Al2O3+2Fe的反应,转化关系中G+J(HNO3)→M+L(N0),推断G为Fe,H为Al2O3;M为Fe(NO3)2或Fe(NO3)2;由A为SO2推断,B为SO3,C溶液为硫酸溶液;C溶液和M溶液反应生成L(NO),证明M为Fe(NO3)2的溶液,F为三价铁盐溶液,E为Fe(OH)3,依据判断出的物质进行分析判断回答问题;
Ⅱ、①依据原电池的原理结合电池反应,正极反应是得到电子发生还原反应的电极反应,是铵根离子得到电子的反应;
②若每2mol NO2和Na2CO3溶液反应时转移电子1mol计算生成的硝酸,根据化合价的变化判断生成物,以此书写反应的离子方程式.
Ⅱ、①依据原电池的原理结合电池反应,正极反应是得到电子发生还原反应的电极反应,是铵根离子得到电子的反应;
②若每2mol NO2和Na2CO3溶液反应时转移电子1mol计算生成的硝酸,根据化合价的变化判断生成物,以此书写反应的离子方程式.
解答:Ⅰ、I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,可以推断I为Al,K是L和氧气反应生成的一种红棕色气体,判断为NO2,L为NO,J为HNO3;D的俗名叫铁红为Fe2O3,A是形成酸雨的主要气体为SO2,依据I+D=G+H,判断为2Al+Fe2O3=Al2O3+2Fe的反应,转化关系中G+J(HNO3)→M+L(N0),推断G为Fe,H为Al2O3;M为Fe(NO3)2或Fe(NO3)2;由A为SO2推断,B为SO3,C溶液为硫酸溶液;C溶液和M溶液反应生成L(NO),证明M为Fe(NO3)2的溶液,F为三价铁盐溶液,E为Fe(OH)3,
(1)依据推导得到各物质的化学式为:L、NO;C、H2SO4 ;E、Fe(OH)3,故答案为:NO;H2SO4 ;Fe(OH)3;
(2)反应②是化合反应属于氧化还原反应、③是化合反应不是氧化还原反应、⑥是氢氧化铁的分解反应、⑨是氧化还原反应,既属于化合反应又属于氧化还原反应是②.故答案为:②
(3)反应⑨是二氧化氮和水中的反应,3NO2+H2O=2HNO3+NO;反应中氧化剂与还原剂都是二氧化氮,氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
(4)反应⑦是铝和氧化铁发生的铝热反应,反应的化学方程式是:Fe2O3+2Al
Al2O3+2Fe;
Ⅱ(1)反应的总反应式为Mg+2NH4Cl=MgCl2+2NH3↑+H2↑,则2NH4+在正极上得电子生成NH3和H2,发生还原反应电极反应式为:2NH4++2e-=2NH3↑+H2↑,
故答案为:2NH4++2e-=2NH3↑+H2↑;
(2)每2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,
故答案为:2NO2+CO32-=NO3-+NO2-+CO2.
(1)依据推导得到各物质的化学式为:L、NO;C、H2SO4 ;E、Fe(OH)3,故答案为:NO;H2SO4 ;Fe(OH)3;
(2)反应②是化合反应属于氧化还原反应、③是化合反应不是氧化还原反应、⑥是氢氧化铁的分解反应、⑨是氧化还原反应,既属于化合反应又属于氧化还原反应是②.故答案为:②
(3)反应⑨是二氧化氮和水中的反应,3NO2+H2O=2HNO3+NO;反应中氧化剂与还原剂都是二氧化氮,氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
(4)反应⑦是铝和氧化铁发生的铝热反应,反应的化学方程式是:Fe2O3+2Al
| ||
Ⅱ(1)反应的总反应式为Mg+2NH4Cl=MgCl2+2NH3↑+H2↑,则2NH4+在正极上得电子生成NH3和H2,发生还原反应电极反应式为:2NH4++2e-=2NH3↑+H2↑,
故答案为:2NH4++2e-=2NH3↑+H2↑;
(2)每2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,
故答案为:2NO2+CO32-=NO3-+NO2-+CO2.
点评:本题考查较为综合,涉及化学反应类型、原电池的原理应用,氧化还原反应等知识,物质的量不同产物不同,利用反应的量判断生成产物,题目难度中等,注意把握电极反应式的书写方法.

练习册系列答案
相关题目