题目内容
某同学欲探究SO2的还原性和酸性氧化物的性质,设计了如图所示的实验:
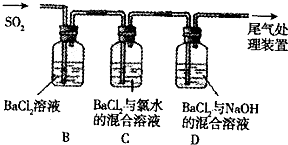
先通N2,将装置中的空气排净,然后通入SO2.请回答:
(1)B中的现象是______.
(2)C中的现象是______,出现该现象的原因是______,______(用离子方程式表示).
(3)D中的现象是______,出现该现象的原因是______,______(用离子方程式表示).
(4)通过上述实验得出的结论是:SO2与BaCl2溶液在______或______条件下会生成沉淀.

先通N2,将装置中的空气排净,然后通入SO2.请回答:
(1)B中的现象是______.
(2)C中的现象是______,出现该现象的原因是______,______(用离子方程式表示).
(3)D中的现象是______,出现该现象的原因是______,______(用离子方程式表示).
(4)通过上述实验得出的结论是:SO2与BaCl2溶液在______或______条件下会生成沉淀.
(1)二氧化硫在碱性条件下可以和钡离子之间发生反应生成白色沉淀,在中性环境下不会发生该反应,故答案为:无明显现象;
(2)氯气具有氧化性,可以将二氧化硫在水溶液中氧化,即SO2+Cl2+2H2O=4H++2Cl-+SO42-,然后是SO42-+Ba2+=BaSO4↓,故答案为:SO2+Cl2+2H2O=4H++2Cl-+SO42;SO42-+Ba2+=BaSO4↓;
(3)在碱性环境下,二氧化硫可以和氢氧根之间发生反应生成亚硫酸根离子,SO2+2OH-=SO32-+H2O,亚硫酸根离子可以和钡离子之间发生反应,即SO32-+Ba2+=BaSO3↓,故答案为:产生白色沉淀;SO2+2OH-=SO32-+H2O;SO32-+Ba2+=BaSO3↓;
(4)根据上述实验的现象得出结论:SO2与BaCl2溶液在强氧化剂存在或是碱性条件下会生成沉淀,故答案为:强氧化剂存在;碱性.
(2)氯气具有氧化性,可以将二氧化硫在水溶液中氧化,即SO2+Cl2+2H2O=4H++2Cl-+SO42-,然后是SO42-+Ba2+=BaSO4↓,故答案为:SO2+Cl2+2H2O=4H++2Cl-+SO42;SO42-+Ba2+=BaSO4↓;
(3)在碱性环境下,二氧化硫可以和氢氧根之间发生反应生成亚硫酸根离子,SO2+2OH-=SO32-+H2O,亚硫酸根离子可以和钡离子之间发生反应,即SO32-+Ba2+=BaSO3↓,故答案为:产生白色沉淀;SO2+2OH-=SO32-+H2O;SO32-+Ba2+=BaSO3↓;
(4)根据上述实验的现象得出结论:SO2与BaCl2溶液在强氧化剂存在或是碱性条件下会生成沉淀,故答案为:强氧化剂存在;碱性.

练习册系列答案
相关题目
 (2)若把0.1 mol铁粉和1.6 g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标准状况下明显少于2.24 L,其原因是__________________________________________________。
(2)若把0.1 mol铁粉和1.6 g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标准状况下明显少于2.24 L,其原因是__________________________________________________。