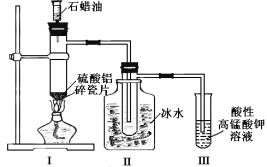
题目内容
【题目】下列电离方程式书写正确的是( )
A.NaHCO3 = Na++H++CO32-
B.(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
C.H2S![]() 2H++S2-
2H++S2-
D.Al(OH)3![]() H++AlO2-+H2O
H++AlO2-+H2O
【答案】D
【解析】
书写离子方程式时,完全电离用等号,部分电离用可逆号;弱酸的酸式酸根离子不能完全电离,如HCO3-、HSO3-,强酸的酸式酸根离子能完全电离,如HSO4-;弱酸分步电离分步写;氢氧化铝有两性,酸式电离体现了它的酸性。据此判断。
A.HCO3–不能完全电离,在写强电解质的电离方程式时不能拆开,A选项错误;
B.(NH4)2SO4是盐,属强电解质,完全电离,电离方程式应用“=”, B选项错误;
C.二元弱酸的电离方程式要分步写:H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-,C选项错误;
H++S2-,C选项错误;
D.Al(OH)3是两性氢氧化物,即能发生酸式电离,又能发生碱式电离,酸式电离为:Al(OH)3![]() H++AlO2-+H2O,D选项正确。
H++AlO2-+H2O,D选项正确。
答案选D。

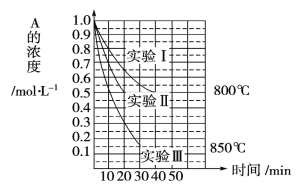
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。