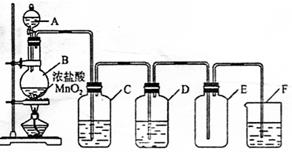
题目内容
从固体物质A开始,可以发生如下框图所示的一系列变化:
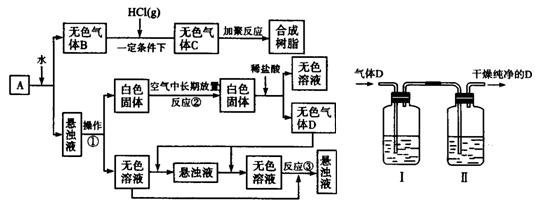
完成下面问题:
(1)在实验室中收集气体B的方法是 。
(2)操作①的名称是 。
在操作①中所使用的玻璃仪器的名称是 。
(3)写出反应②和反应③的化学方程式:
反应②
反应③ 。
(4)A的化学式是 。
(5)在实验室中,如要获得干燥纯净的气体D,可以将它通过如上右图所示的装置,其中瓶I中盛放的试剂是 ,瓶Ⅱ中盛放的试剂是 。
收集干燥气体D的方法是 。

完成下面问题:
(1)在实验室中收集气体B的方法是 。
(2)操作①的名称是 。
在操作①中所使用的玻璃仪器的名称是 。
(3)写出反应②和反应③的化学方程式:
反应②
反应③ 。
(4)A的化学式是 。
(5)在实验室中,如要获得干燥纯净的气体D,可以将它通过如上右图所示的装置,其中瓶I中盛放的试剂是 ,瓶Ⅱ中盛放的试剂是 。
收集干燥气体D的方法是 。
(1)排水集气法
(2)过滤;漏斗、玻璃棒、烧杯
(3)Ca(OH)2+CO2=CaCO3↓+H2O;Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O
(4)CaC2
(5)饱和碳酸氢钠溶液,浓硫酸。向上排空气法
(2)过滤;漏斗、玻璃棒、烧杯
(3)Ca(OH)2+CO2=CaCO3↓+H2O;Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O
(4)CaC2
(5)饱和碳酸氢钠溶液,浓硫酸。向上排空气法
略

练习册系列答案
相关题目

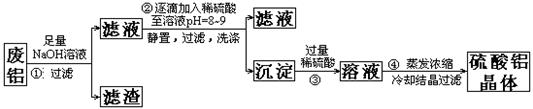
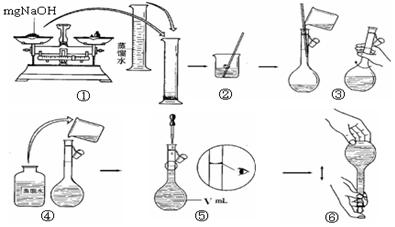
 确程序 。
确程序 。 馏水
馏水
 ______________________,
______________________, 满的方法:____________________________________________________;
满的方法:____________________________________________________;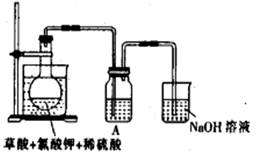
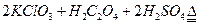
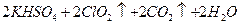
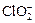 )。饮用水中ClO2、
)。饮用水中ClO2、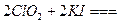
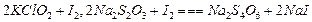 ,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为 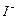 将溶液中的
将溶液中的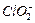 还原为
还原为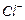 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为: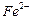 将
将