题目内容
13.下列各组离子能大量共存的是( )?| A. | K+、NH4+、SO42-、NO3- | B. | H+、K+、HS-、SO42-? | ||
| C. | Fe2+、H+、Cl-、NO3- | D. | Na+、Ba2+、S2-、SO3 2- |
分析 如离子之间不发生反应生成沉淀、气体、弱电解质或不发生氧化还原反应、互促水解等类型的反应,则离子能大量共存.
解答 解:A.离子之间不发生任何反应,能大量共存,故A正确;
B.H+、HS-反应生成硫化氢气体,不能大量共存,故B错误;
C.Fe2+、H+、NO3-发生氧化还原反应而不能大量共存,故C错误;
D.Ba2+、SO32-反应生成沉淀而不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,为高频考点,侧重于学生的分析能力的考查,注意把握常见离子的性质以及反应类型的判断,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
8.下列能用分液漏斗分离的混合物是( )
| A. | 液溴和四氯化碳 | B. | 乙酸和乙醇 | ||
| C. | 乙酸乙酯和蒸馏水 | D. | 溴苯和苯 |
4.化学来源于生活,并应用于生产生活中.下列关于化学与生产、生活的认识不正确的是( )
| A. | 将煤气化、液化等方法处理,是提高燃料燃烧效率的重要措施之一 | |
| B. | CO2、CxHy、N2等均是造成温室效应的气体 | |
| C. | 乙醇、天然气、液化石油气、氢气都可以作为燃料电池的原料,其中氢气是最为环保的原料 | |
| D. | 合理开发利用可燃冰(固态甲烷水台物)有助于缓解能源紧缺 |
18.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.下列关于不溶物之间转化的说法中错误的是( )
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{8.5}{\sqrt{1.8}}$×10-12mol•L-1 |
5.下列说法中正确的是( )
①${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质
②元素周期表中元素排列顺序的依据是元素的相对原子质量
③原子的种类大于元素的种类
④所有的原子都含有质子、中子、电子
⑤质子数相同的微粒一定是同种元素
⑥质子数相同、电子数也相同的两种微粒,不可能一种是分子,另一种是离子
⑦同种元素的原子只能有一种质量数
⑧两原子如果核外电子排布相同,则一定属于同种元素
⑨第四、五、六周期称为长周期
⑩过渡元素包括了大部分金属元素.
①${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质
②元素周期表中元素排列顺序的依据是元素的相对原子质量
③原子的种类大于元素的种类
④所有的原子都含有质子、中子、电子
⑤质子数相同的微粒一定是同种元素
⑥质子数相同、电子数也相同的两种微粒,不可能一种是分子,另一种是离子
⑦同种元素的原子只能有一种质量数
⑧两原子如果核外电子排布相同,则一定属于同种元素
⑨第四、五、六周期称为长周期
⑩过渡元素包括了大部分金属元素.
| A. | ①②③⑥⑧ | B. | ③⑥⑧⑨⑩ | C. | ②③⑤⑥⑦ | D. | ④⑤⑥⑨⑩ |
2.在一个不传热的固定容积的密闭容器中,可逆反应N2+3H2?2NH3达到平衡的标志是( )
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3molH-H键断裂,同时2molN-H键断裂 | |
| C. | n(N2):n(H2):(NH3)=1:3:2 | |
| D. | 反应混合物的压强不再改变 |
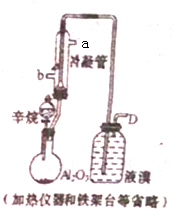 现以C8H18为原理经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,
现以C8H18为原理经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置, Ω=2,则有机物
Ω=2,则有机物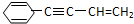 的不饱和度为( )
的不饱和度为( )