��Ŀ����
ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������֪ʶ����������������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ��K=
��������Ӧ�Ļ�ѧ��ӦΪ�� ��
��2������ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g��?CH3OH��g������H=-90.8kJ?mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g������H=-23.5kJ?mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g������H=-41.3kJ?mol-1
�ܷ�Ӧ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g���ġ�H= �������ѣ�CH3OCH3��ֱ����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������Ϊ���ԣ��õ�صĸ�����ӦΪ ��
��3��ú����ͨ��ͨ���о���ͬ�¶���ƽ�ⳣ���Խ������ʵ�����⣮��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
�÷�Ӧ������Ӧ������ ��Ӧ������ȡ����ȡ���������500��ʱ���У�����ʼʱCO��H2O����ʼŨ�Ⱦ�Ϊ0.020mol/L���ڸ������£�CO��ƽ��ת����Ϊ�� ��
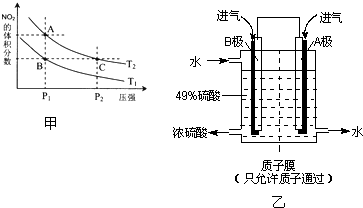
��4���Ӱ����������������ᣬ�˹������漰���������NO��NO2��N2O4�ȣ��Է�ӦN2O4��g��?2NO2��g����H��0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ����ʾ������˵����ȷ���� ��
A��A��C����ķ�Ӧ���ʣ�A��C
B��A��C�����������ɫ��A�Cdz
C��B��C����������ƽ����Է���������B��C
D����״̬B��״̬A�������ü��ȵķ���
E��A��C����Ļ�ѧƽ�ⳣ����A��C
��5��NO2���ð�ˮ��������NH4NO3��25��ʱ����m mol NH4NO3����ˮ����Һ�����ԣ������Һ�μ�n L��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫ ������������������ƶ������μӰ�ˮ��Ũ��Ϊ mol?L-1����NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10-5mol?L-1��
��6��ij���е�λ����ԭ���ԭ������SO2��O2���Ʊ����ᣬװ����ͼ����ʾ���缫Ϊ��IJ������������壬ͬʱҲ��ʹ������������Һ��ֽӴ���
����Һ��H+���ƶ������� ���� ��������A��B��ʾ��
��B�缫�ĵ缫��ӦʽΪ ��

��1����֪ij��Ӧ��ƽ�����ʽΪ��K=
| c(H2)?c(CO) |
| c(H2O) |
��2������ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g��?CH3OH��g������H=-90.8kJ?mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g������H=-23.5kJ?mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g������H=-41.3kJ?mol-1
�ܷ�Ӧ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g���ġ�H=
��3��ú����ͨ��ͨ���о���ͬ�¶���ƽ�ⳣ���Խ������ʵ�����⣮��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
��4���Ӱ����������������ᣬ�˹������漰���������NO��NO2��N2O4�ȣ��Է�ӦN2O4��g��?2NO2��g����H��0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ����ʾ������˵����ȷ����
A��A��C����ķ�Ӧ���ʣ�A��C
B��A��C�����������ɫ��A�Cdz
C��B��C����������ƽ����Է���������B��C
D����״̬B��״̬A�������ü��ȵķ���
E��A��C����Ļ�ѧƽ�ⳣ����A��C
��5��NO2���ð�ˮ��������NH4NO3��25��ʱ����m mol NH4NO3����ˮ����Һ�����ԣ������Һ�μ�n L��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫
��6��ij���е�λ����ԭ���ԭ������SO2��O2���Ʊ����ᣬװ����ͼ����ʾ���缫Ϊ��IJ������������壬ͬʱҲ��ʹ������������Һ��ֽӴ���
����Һ��H+���ƶ�������
��B�缫�ĵ缫��ӦʽΪ
���㣺��ѧƽ���Ӱ������,�Ȼ�ѧ����ʽ,��ѧ��Դ���͵��,���������ˮ��Һ�еĵ���ƽ��
ר�⣺�����������������
��������1������ƽ�ⳣ���Ķ����жϷ�Ӧ�ķ���ʽ��
��2�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ������ȼ�ϵ����������Һ�з�Ӧԭ����ȼ��������ʧ�������ɶ�����̼����ϵ���غ���д�缫��Ӧ��
��3���¶�����Kֵ��С����������ӦΪ���ȷ�Ӧ����CO��Ũ�ȱ仯Ϊc��������ʽ��ʾ�������ʱ仯��Ũ�ȡ�ƽ��ʱ��Ũ�ȣ��ٸ���ƽ�ⳣ�����㣻
��4����ƽ���ƶ��ĽǶȷ������������ı仯��
��5������笠�����ˮ������ش�����ͬ����ЧӦ��һˮ�ϰ���笠�����ˮ�����������ã�����һˮ�ϰ��ĵ���ƽ�ⳣ������õ���ˮŨ�ȣ�
��6������ΪSO2��O2��Ӧ����SO3��SO3����ˮ�����������ᣬ��������ij����ж�����������������������Ӧ������������ԭ��Ӧ��ԭ��طŵ�ʱ���������Һ���������������ƶ���
��2�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ������ȼ�ϵ����������Һ�з�Ӧԭ����ȼ��������ʧ�������ɶ�����̼����ϵ���غ���д�缫��Ӧ��
��3���¶�����Kֵ��С����������ӦΪ���ȷ�Ӧ����CO��Ũ�ȱ仯Ϊc��������ʽ��ʾ�������ʱ仯��Ũ�ȡ�ƽ��ʱ��Ũ�ȣ��ٸ���ƽ�ⳣ�����㣻
��4����ƽ���ƶ��ĽǶȷ������������ı仯��
��5������笠�����ˮ������ش�����ͬ����ЧӦ��һˮ�ϰ���笠�����ˮ�����������ã�����һˮ�ϰ��ĵ���ƽ�ⳣ������õ���ˮŨ�ȣ�
��6������ΪSO2��O2��Ӧ����SO3��SO3����ˮ�����������ᣬ��������ij����ж�����������������������Ӧ������������ԭ��Ӧ��ԭ��طŵ�ʱ���������Һ���������������ƶ���
���
�⣺��1��ƽ�ⳣ��Ϊ�������Ũ����֮�����Է�Ӧ���Ũ����֮����ƽ�ⳣ���У�����Ϊ�������ĸΪ��Ӧ��ٽ�������غ㶨�ɣ����Ը÷�Ӧ�ķ���ʽΪC��s��+H2O��g��?CO��g��+H2��g�����ʴ�Ϊ��C��s��+H2O��g��?CO��g��+H2��g����
��2����2H2��g��+CO��g��?CH3OH��g������H=-90.8kJ?mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g������H=-23.5kJ?mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g������H=-41.3kJ?mol-1
���ݸ�˹���ɼ���١�2+��+�۵õ��ܷ�Ӧ���Ȼ�ѧ����ʽ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g����H=-246.4KJ/mol��
�����ѣ�CH3OCH3��ֱ����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������Ϊ���ԣ��õ�صĸ�����ӦΪ������ʧ�������ɶ�����̼���缫��ӦΪ��CH3OCH3-12e-+3H2O=2CO2+12H+��
�ʴ�Ϊ��-246.4KJ/mol��CH3OCH3-12e-+3H2O=2CO2+12H+��
��3���¶�����Kֵ��С����������ӦΪ���ȷ�Ӧ��
���ڷ�Ӧ CO��g��+H2O��g��?H2��g��+CO2��g����
��ʼ��mol/L����0.02 0.02 0 0
�仯��mol/L����c c c c
ƽ�⣨mol/L����0.02-c 0.02-c c c
����
=9�����c=0.015��
����CO��ת����Ϊ
��100%=75%��
�ʴ�Ϊ�����ȣ�75%��
��4���Է�ӦN2O4��g��?2NO2��g�������¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ2��ʾ����
A��A��ѹǿС��C���ѹǿ��ѹǿԽ��Ӧ����Խ����Ӧ���ʣ�A��C����A����
B������ѹǿ��ƽ��������Ӧ�ƶ�����Ũ�ȵ�������ȴ���ת���ij̶ȣ�����C��Ũ�ȴ���ɫ���B����
C��B��C����������������������ͬ�����������ƽ����Է���������ͬ����C����
D������ͬѹǿ�£������¶ȣ�ƽ�����淴Ӧ�����ƶ�������������������������������״̬B��״̬A�������ü��ȵķ�������D��ȷ��
E��A��C����Ļ�ѧƽ�ⳣ�����¶���ͬ��ƽ�ⳣ����ȣ���E����
�ʴ�Ϊ��D��
��5��NO2���ð�ˮ��������NH4NO3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�����Ϊ笠�����ˮ�⣻��Ӧ�����ӷ���ʽΪ��NH4++H2O?NH3?H2O+H+�����백ˮ��Һ����笠�����ˮ�⣬ƽ��������У���a mol NH4NO3����ˮ�������Һ�μ�b L ��ˮ����Һ�����ԣ����ݵ���غ�����֪����Һ������������Ũ��=10-7mol/L��c��NH4+��=c��NO3-����NH3?H2O�ĵ���ƽ�ⳣ��ȡKb=2��10-5 mol?L-1�����Ϻ���Һ���Ϊ1L����NH4+��=c��NO3-��=amol/L������һˮ�ϰ�����ƽ��õ���NH3?H2O?NH4++OH-��ƽ�ⳣ��K=
=
=2��10-5 mol?L-1������õ�c��NH3?H2O��=
mol/L��
�ʴ�Ϊ������
��
��6����ԭ����У�������ʧ���ӱ����������Ը�����Ͷ�ŵ������Ƕ�������������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ�������Ͷ�ŵ������������������������õ��Ӻ������ӷ�Ӧ����ˮ�����������ˮ�ij��ڷ���֪��B���Ǹ�����A��������������B���ϵĵ缫��ӦʽΪ��SO2-2e-+2H2O�TSO42-+4H+��ԭ��طŵ�ʱ���������ɸ���B��������A���������ط�ӦʽΪ��2SO2+O2+2H2O=2H2SO4��
�ʴ�Ϊ��B��A��SO2-2e-+2H2O�TSO42-+4H+��
��2����2H2��g��+CO��g��?CH3OH��g������H=-90.8kJ?mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g������H=-23.5kJ?mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g������H=-41.3kJ?mol-1
���ݸ�˹���ɼ���١�2+��+�۵õ��ܷ�Ӧ���Ȼ�ѧ����ʽ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g����H=-246.4KJ/mol��
�����ѣ�CH3OCH3��ֱ����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������Ϊ���ԣ��õ�صĸ�����ӦΪ������ʧ�������ɶ�����̼���缫��ӦΪ��CH3OCH3-12e-+3H2O=2CO2+12H+��
�ʴ�Ϊ��-246.4KJ/mol��CH3OCH3-12e-+3H2O=2CO2+12H+��
��3���¶�����Kֵ��С����������ӦΪ���ȷ�Ӧ��
���ڷ�Ӧ CO��g��+H2O��g��?H2��g��+CO2��g����
��ʼ��mol/L����0.02 0.02 0 0
�仯��mol/L����c c c c
ƽ�⣨mol/L����0.02-c 0.02-c c c
����
| c��c |
| (0.02-c)(0.02-c) |
����CO��ת����Ϊ
| 0.015mol/L |
| 0.02mol/L |
�ʴ�Ϊ�����ȣ�75%��
��4���Է�ӦN2O4��g��?2NO2��g�������¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ2��ʾ����
A��A��ѹǿС��C���ѹǿ��ѹǿԽ��Ӧ����Խ����Ӧ���ʣ�A��C����A����
B������ѹǿ��ƽ��������Ӧ�ƶ�����Ũ�ȵ�������ȴ���ת���ij̶ȣ�����C��Ũ�ȴ���ɫ���B����
C��B��C����������������������ͬ�����������ƽ����Է���������ͬ����C����
D������ͬѹǿ�£������¶ȣ�ƽ�����淴Ӧ�����ƶ�������������������������������״̬B��״̬A�������ü��ȵķ�������D��ȷ��
E��A��C����Ļ�ѧƽ�ⳣ�����¶���ͬ��ƽ�ⳣ����ȣ���E����
�ʴ�Ϊ��D��
��5��NO2���ð�ˮ��������NH4NO3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�����Ϊ笠�����ˮ�⣻��Ӧ�����ӷ���ʽΪ��NH4++H2O?NH3?H2O+H+�����백ˮ��Һ����笠�����ˮ�⣬ƽ��������У���a mol NH4NO3����ˮ�������Һ�μ�b L ��ˮ����Һ�����ԣ����ݵ���غ�����֪����Һ������������Ũ��=10-7mol/L��c��NH4+��=c��NO3-����NH3?H2O�ĵ���ƽ�ⳣ��ȡKb=2��10-5 mol?L-1�����Ϻ���Һ���Ϊ1L����NH4+��=c��NO3-��=amol/L������һˮ�ϰ�����ƽ��õ���NH3?H2O?NH4++OH-��ƽ�ⳣ��K=
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| amol/L��10-7mol/L |
| bL��c(NH3?H2O)mol/L |
| a |
| 200b |
�ʴ�Ϊ������
| a |
| 200b |
��6����ԭ����У�������ʧ���ӱ����������Ը�����Ͷ�ŵ������Ƕ�������������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ�������Ͷ�ŵ������������������������õ��Ӻ������ӷ�Ӧ����ˮ�����������ˮ�ij��ڷ���֪��B���Ǹ�����A��������������B���ϵĵ缫��ӦʽΪ��SO2-2e-+2H2O�TSO42-+4H+��ԭ��طŵ�ʱ���������ɸ���B��������A���������ط�ӦʽΪ��2SO2+O2+2H2O=2H2SO4��
�ʴ�Ϊ��B��A��SO2-2e-+2H2O�TSO42-+4H+��
���������⿼�黯ѧƽ�ⳣ����ƽ���ƶ���ؼ��㡢ԭ���ԭ��Ӧ�á�����ˮ���жϡ�������ʵ���ƽ�����Ӧ�õȣ���Ŀ��Ϊ�ۺϣ��漰����֪ʶ���Ѷ��еȣ�������ע�����ͼ�����������ԭ��ص缫��Ӧ����дӦ�ã�

��ϰ��ϵ�д�
�����Ŀ
�������ʷ����У���ԭ�Ӿ�����ͬһƽ����Ǣټ��� ������ ����ϩ �ܱ��� �ݱ���������
| A���٢� | B���٢� | C���ڢ� | D���ۢ� |
�������������ȡ����Ӧ���ɶ��ȱ����ͬ���칹�����Ŀ�У�������
| A��2�� | B��3�� | C��4�� | D��5�� |
 ��1��ͼ����ʵ���ҳ��õ�һ����������������
��1��ͼ����ʵ���ҳ��õ�һ����������������