题目内容
【题目】某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液。实验操作过程如下:
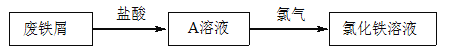
根据要求回答问题:
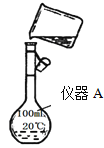
(1)用浓盐酸配制250mL 0.2molL-1稀盐酸,图中有两处错误分别是_____________,______________。
(2)废铁屑用盐酸处理后,还含有不溶性杂质,为获取澄清的A溶液,进行物质分离的操作名称是___________。
(3)若FeCl2溶液中混有少量的FeCl3溶液,现要加入一种试剂除去FeCl3,请写出除杂的离子方程式______________________。
(4)配制250mL 0.2molL-1稀盐酸时,下列操作会造成结果偏高的是(_______)
A.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
B.转移溶液前溶液未冷却至室温
C.未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶的刻度线
E.容量瓶洗涤干净后,瓶内壁有少量水滴。
【答案】转移溶液时未用玻璃棒引流 应选用250 mL容量瓶 过滤 2Fe3++Fe=3Fe2+ BD
【解析】
根据配制溶液的实验,分析实验操作是否正确,并据c=n/V进行误差分析。根据除杂的原则分析除杂的方法和试剂的选择。
(1)配制250mL 0.2molL-1稀盐酸,应选用250 mL容量瓶。向容量瓶中转移溶液时未用玻璃棒引流。
(2)除去不溶性杂质,以获得澄清的A溶液,应进行过滤。
(3)使用铁粉除去FeCl2溶液中的少量FeCl3杂质,除杂的离子方程式是2Fe3++Fe=3Fe2+。
(4)A.若加水超过容量瓶刻度,再用胶头滴管吸出多余溶液,也吸出了部分溶质,使浓度偏低;
B.溶液未冷却至室温即转移至容量瓶,自然降温后体积偏小,浓度偏高;
C.未洗涤烧杯和玻璃棒,溶质损失,浓度偏低;
D.定容时俯视容量瓶的刻度线,使溶液体积偏小,浓度偏高;
E.容量瓶洗涤干净后,瓶内壁有少量水滴,对溶液浓度无影响。
选BD。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D