题目内容
元素A和B分别是处于第三、四周期的主族元素,它们的离子的电子层相差两层。已知A处于第m主族,B处于第n主族,且B的单质中含有共价键。
(1)A原子核外的电子总数是___________,最高价氧化物的化学式是___________。
(2)B原子的结构示意图是___________,其气态氢化物的化学式是___________。
(3)若它们的离子均带一个单位的电荷,则A是___________元素,B单质的电子式为___________。
(1)A原子核外的电子总数是___________,最高价氧化物的化学式是___________。
(2)B原子的结构示意图是___________,其气态氢化物的化学式是___________。
(3)若它们的离子均带一个单位的电荷,则A是___________元素,B单质的电子式为___________。
(1)m+10 A2Om或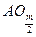 ,
,
(2)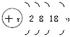 ,其中x="28+n " H(8-n)R或RH(8-n)
,其中x="28+n " H(8-n)R或RH(8-n)
(3)钠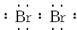
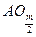 ,
,(2)
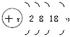 ,其中x="28+n " H(8-n)R或RH(8-n)
,其中x="28+n " H(8-n)R或RH(8-n)(3)钠
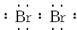
(1)A原子位于第三周期,即有三个电子层,第一、二层排满共有10个电子,第三层为最外层,所排的电子数等于族序数,即m个电子,故A原子核外电子总数为(10+m)个,最高价也与族序数相等,即+m价,故最高价氧化物的化学式为A2Om或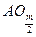 ;(2)同理分析可得B原子有四个电子层,每层所排电子数依次为2、8、18、n(这里容易出错的是第三层排8个电子,因B有气态氢化物,说明B是非金属元素,其位置在过渡区之后,故正确的是排18个电子),B原子的最高价为+n,则在气态氢化物中显示-(8-n)价,故结构示意图和气态氢化物的化学式依次为:
;(2)同理分析可得B原子有四个电子层,每层所排电子数依次为2、8、18、n(这里容易出错的是第三层排8个电子,因B有气态氢化物,说明B是非金属元素,其位置在过渡区之后,故正确的是排18个电子),B原子的最高价为+n,则在气态氢化物中显示-(8-n)价,故结构示意图和气态氢化物的化学式依次为: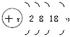 ,其中x=28+n,H(8-n)R或RH(8-n);(3)根据题意,A是钠元素,B是溴元素,则B单质的电子式为∶
,其中x=28+n,H(8-n)R或RH(8-n);(3)根据题意,A是钠元素,B是溴元素,则B单质的电子式为∶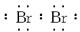 。
。
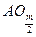 ;(2)同理分析可得B原子有四个电子层,每层所排电子数依次为2、8、18、n(这里容易出错的是第三层排8个电子,因B有气态氢化物,说明B是非金属元素,其位置在过渡区之后,故正确的是排18个电子),B原子的最高价为+n,则在气态氢化物中显示-(8-n)价,故结构示意图和气态氢化物的化学式依次为:
;(2)同理分析可得B原子有四个电子层,每层所排电子数依次为2、8、18、n(这里容易出错的是第三层排8个电子,因B有气态氢化物,说明B是非金属元素,其位置在过渡区之后,故正确的是排18个电子),B原子的最高价为+n,则在气态氢化物中显示-(8-n)价,故结构示意图和气态氢化物的化学式依次为: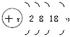 ,其中x=28+n,H(8-n)R或RH(8-n);(3)根据题意,A是钠元素,B是溴元素,则B单质的电子式为∶
,其中x=28+n,H(8-n)R或RH(8-n);(3)根据题意,A是钠元素,B是溴元素,则B单质的电子式为∶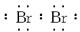 。
。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
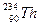 的原子来说( )
的原子来说( )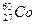 放射源进行了实验验证。次年,杨振宁、李政道两人因此获得诺贝尔物理奖。
放射源进行了实验验证。次年,杨振宁、李政道两人因此获得诺贝尔物理奖。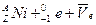
 B单质+A、C化合物
B单质+A、C化合物