��Ŀ����
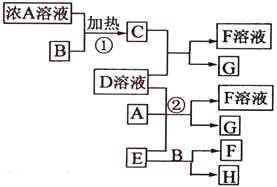
����Ŀ���й����ʴ�����ͼ��ʾ��ת����ϵ(���ֲ�����ʡ��)��ͨ��CΪ���嵥�ʣ�GΪ�Ϻ�ɫ���嵥�ʡ�ʵ�����У����ù���E��B�Ĵ��¼�����ȡ���嵥��H��
��ش��������⣺
(1)��Ӧ���Ļ�ѧ����ʽΪ_____________________
(2)��Ӧ�������ӷ���ʽΪ_____________________
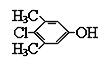
(3)д������һ��ʵ������ȡH�Ļ�ѧ����ʽ____________________________
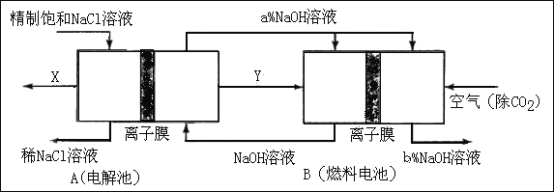
(4)D��Һ��Pb(NO3)2��Һ��Ͽ��γɳ������˳�����Ksp=7.0��10��9�����������D��Һ��Pb(NO3)2��Һ��ϣ���D��Ũ��Ϊ1��10��2mo1/L �������ɳ�������Pb(NO3)2��Һ����СŨ��Ϊ___________________��
���𰸡���Ӧ���ķ���ʽ��4HCl(Ũ) + MnO2![]() MnCl2 + Cl2�� + 2H2O ��Ӧ�������ӷ���ʽ��6I��+ ClO3-+ 6H��= 3I2+Cl��+ 3H2O 2H2O2
MnCl2 + Cl2�� + 2H2O ��Ӧ�������ӷ���ʽ��6I��+ ClO3-+ 6H��= 3I2+Cl��+ 3H2O 2H2O2![]() 2H2O + O2��(Ҳ���ø�����ؼ��ȷֽ�) D��Һ��Pb(NO3)2 ��Ӧ���ɳ���ΪPbI2��PbI2
2H2O + O2��(Ҳ���ø�����ؼ��ȷֽ�) D��Һ��Pb(NO3)2 ��Ӧ���ɳ���ΪPbI2��PbI2![]() Pb2++ 2I- ��
Pb2++ 2I- ��
Ksp= c(Pb2+)��c(I-)2= c(Pb(NO3)2 ) ��2 ��(10-2��2)2= 7.0��10-9��
����c(Pb(NO3)2 ) = 5.6��10-4mol��L-1
��������
ʵ�����У����ù���E��B�Ĵ��¼�����ȡ���嵥��H������ƶ�֪EΪ����أ�BΪ�������̣�HΪ������GΪ�Ϻ�ɫ���嵥�ʣ����ƶ�GΪ�ⵥ�ʣ�A��Ũ��Һ��B��������C�����Ƶ�C����Ϊ��������AΪ���ᣬ��ӦC��D��Һ��Ӧ����F��Һ��G����DΪ�⻯�أ�FΪ�Ȼ��أ��ݴ˴��⡣
(1)��Ӧ��Ϊʵ�����������ķ�Ӧ,��Ӧ�Ļ�ѧ����ʽΪ4HCl(Ũ) + MnO2![]() MnCl2+ Cl2�� + 2H2O��
MnCl2+ Cl2�� + 2H2O��
��ˣ�������ȷ����: 4HCl(Ũ) + MnO2![]() MnCl2+ Cl2�� + 2H2O ��
MnCl2+ Cl2�� + 2H2O ��
(2)��Ӧ��Ϊ����������������������⻯�أ���Ӧ�����ӷ���ʽΪ6I��+ ClO3-+ 6H��= 3I2+Cl��+ 3H2O��
��ˣ�������ȷ���ǣ�6I��+ ClO3-+ 6H��= 3I2+Cl��+ 3H2O��
(3)ʵ���ҿ�����˫��ˮ�ֽ�����������Ӧ�Ļ�ѧ����ʽΪ2H2O2![]() 2H2O + O2����
2H2O + O2����
��ˣ�������ȷ����: 2H2O2![]() 2H2O + O2����
2H2O + O2����
��4��D��Һ��Pb(NO3)2��Ӧ���ɳ���ΪPbI2��PbI2![]() Pb2++ 2I-��
Pb2++ 2I-��
Ksp= c(Pb2+)��c(I-)2= c(Pb(NO3)2) ��2 ��(10-2��2)2= 7.0��10-9��
����c(Pb(NO3)2) = 5.6��10-4mol��L-1��
��ˣ�������ȷ���ǣ�5.6��10-4mol��L-1��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�������ģ����������о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�

��1����Ӧ��2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
��Ӧ��S(s)+O2(g)![]() SO2(g) ��H3=��297 kJ��mol��1
SO2(g) ��H3=��297 kJ��mol��1
��Ӧ����Ȼ�ѧ����ʽ��________________��
��2���Է�Ӧ����ijһͶ�ϱ�ʱ������ѹǿ�£�H2SO4��ƽ����ϵ�����ʵ����������¶ȵı仯��ϵ��ͼ��ʾ��

p2_______p 1����������������ó��ý��۵�������________________��
��3��I��������Ϊˮ��Һ��SO2�绯��Ӧ�Ĵ��������ܵĴ��������¡���ii����������
i��SO2+4I��+4H+![]() S��+2I2+2H2O
S��+2I2+2H2O
ii��I2+2H2O+_________![]() _________+_______+2 I��
_________+_______+2 I��
��4��̽��i��ii��Ӧ������SO2�绯��Ӧ���ʵĹ�ϵ��ʵ�����£��ֱ�18 mL SO2������Һ���뵽2 mL�����Լ��У��ܱշ��ù۲�������֪��I2���ܽ���KI��Һ�У�
��� | A | B | C | D |
�Լ���� | 0.4 mol��L��1 KI | a mol��L��1 KI 0.2 mol��L��1 H2SO4 | 0.2 mol��L��1 H2SO4 | 0.2 mol��L��1 KI 0.0002 mol I2 |
ʵ������ | ��Һ��ƣ�һ��ʱ�����ֻ��� | ��Һ��ƣ����ֻ��ǽ�A�� | ���������� | ��Һ���غ�ɫ�ܿ���ɫ����ɻ�ɫ�����ֻ��ǽ�A�� |
��B��A�ĶԱ�ʵ�飬��a=__________��
�ڱȽ�A��B��C���ɵó��Ľ�����______________________��
��ʵ�������SO2���绯��Ӧ����D��A�����i��ii��Ӧ���ʽ���ԭ��________________��