题目内容
 (2010?合肥三模)在一密闭容器中充入4mol SO2和一定量O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H=一196.6kJ?mol-1.则下列说法正确的是( )
(2010?合肥三模)在一密闭容器中充入4mol SO2和一定量O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H=一196.6kJ?mol-1.则下列说法正确的是( )分析:A.催化剂不能改变化学平衡;
B.平衡常数只与温度有关;
C.根据热化学方程式计算;
D.温度升高,平衡向你反应方向移动,SO3的含量降低.
B.平衡常数只与温度有关;
C.根据热化学方程式计算;
D.温度升高,平衡向你反应方向移动,SO3的含量降低.
解答:解:A.提高反应速率可加入催化剂,但加入催化剂不改变化学平衡的移动,故A错误;
B.增大压强有利于SO2转化,但平衡常数不改变,故B错误;
C.当放出353.6 kJ热量时,SO2转化
×2=3.6mol,转化率接近
×100%=90%,故C正确;
D.温度升高,平衡向你反应方向移动,SO3的含量降低,与图象不符合,故D错误.
故选C.
B.增大压强有利于SO2转化,但平衡常数不改变,故B错误;
C.当放出353.6 kJ热量时,SO2转化
| 353.6kJ |
| 196.6kJ/mol |
| 3.6mol |
| 4mol |
D.温度升高,平衡向你反应方向移动,SO3的含量降低,与图象不符合,故D错误.
故选C.
点评:本题考查化学平衡的影响以及化学平衡计算问题,题目难度不大,本提注意化学反应的特点,以及影响平衡移动的因素.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
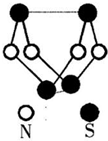 (2010?合肥三模)现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子结构.下列说法错误的是( )
(2010?合肥三模)现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子结构.下列说法错误的是( )