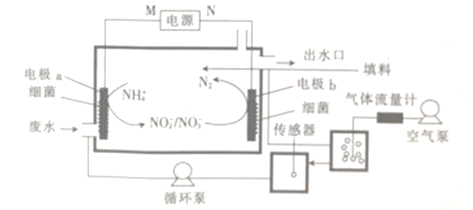
题目内容
【题目】I.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则甲烷燃烧的热化学方程式为__。
Ⅱ科研人员新近开发出一种由甲醇(CH3OH)和氧气以及强碱做电解质溶液的新型手机电池,可供手机连续使用一个月才充一次电,据此请回答以下问题:
(1)甲醇是__极,电极反应为___。
(2)电池反应的离子方程式:__。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=﹣890kJ/mol 负 CH3OH﹣6e-+8OH-=CO32-+6H2O 2CH3OH+3O2+4OH-=2CO32-+6H2O
【解析】
I.依据热化学方程式书写方法书写,标注物质聚集状态,计算对应化学方程式量下的焓变写出热化学方程式;
II.(1)燃料电池中,负极时燃料发生失电子的氧化反应;
(2)燃料电池的总反应是燃料燃烧的方程式,根据电解质环境书写即可。
I.0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,1mol甲烷反应燃烧反应放热![]() ;反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=﹣890kJ/mol,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=﹣890kJ/mol;
;反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=﹣890kJ/mol,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=﹣890kJ/mol;
II.(1)甲醇(CH3OH)和氧气以及强碱作电解质溶液的新型手机电池中,甲醇做负极,发生失电子的氧化反应,即CH3OH﹣6e-+8OH-=CO32-+6H2O,故答案为:负; CH3OH﹣6e-+8OH-=CO32-+6H2O;
(2)料电池的总反应是燃料燃烧的方程式,在碱性环境下,电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O。