题目内容
【题目】完成以下方程式:(1)(2)写离子方程式,(3)(4)(5)(6)写化学方程式
(1)Na与H2O:_____________________________________________
(2)Al与NaOH溶液:__________________________________________
(3)白色沉淀→灰绿色→红褐色:____________________________________
(4)制粗Si:___________________________________________________
(5)Na与O2加热: __________________________________________
(6)少量CO2通入Na2SiO3溶液: __________________________________________________________________ 。
【答案】 2Na+2H2O=2Na++2OH-+H2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 SiO2+2C![]() Si+2CO↑ 2Na+O2
Si+2CO↑ 2Na+O2![]() Na2O2 CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3
Na2O2 CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3
【解析】(1)Na与H2O反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑;(2)Al与NaOH溶液生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)白色沉淀→灰绿色→红褐色是氢氧化亚铁被氧化为氢氧化铁,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)制粗Si的方程式为SiO2+2C![]() Si+2CO↑;(5)Na与O2加热生成过氧化钠,方程式为2Na+O2
Si+2CO↑;(5)Na与O2加热生成过氧化钠,方程式为2Na+O2![]() Na2O2;(6)少量CO2通入Na2SiO3溶液中生成硅酸沉淀和碳酸钠,方程式为CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3。
Na2O2;(6)少量CO2通入Na2SiO3溶液中生成硅酸沉淀和碳酸钠,方程式为CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3。

【题目】在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
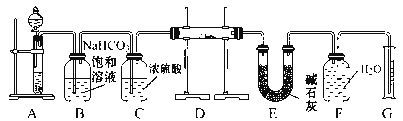
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:____________________。
(2)B、C、E均为除杂装置(U型管中加固体干燥剂)除杂顺序如表:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | 浓硫酸 | _________ |
E | 碱石灰 | _________ |
(3)写出B中发生反应的离子方程式:__________________________________。
(4)写出D中过氧化钠与二氧化碳反应的化学方程式:__________________。
(5)试管F中收集满气体后,证明试管中收集的气体是氧气的实验操作是:_____。
【题目】某无色澄清溶液中Cl﹣浓度为0.5molL﹣1 , 还可能含有表中的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3﹣ CO32﹣ SiO32﹣ SO42﹣ OH﹣ |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子有 . 能确定一定不存在的离子是
(2)实验Ⅰ中生成沉淀的离子方程式为 .
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
阴离子 | 浓度c/(molL﹣1) |
① | |
② | |
③ |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: .