题目内容
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2, Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ;元素Z的离子结构示意图为 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为 。
(3)元素W位于周期表的第 族, 其非金属性比元素R弱,用原子结构的知识解释原
因 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂
与足量该氧化物反应的离子方程式 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在
高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为 。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ;元素Z的离子结构示意图为 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为 。
(3)元素W位于周期表的第 族, 其非金属性比元素R弱,用原子结构的知识解释原
因 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂
与足量该氧化物反应的离子方程式 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在
高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为 。
(共11分)(1)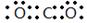 (1分)
(1分) 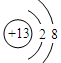 (1分)
(1分)
(2)8 HNO3(稀)+3 Cu=2NO↑+3Cu(NO3)2+4H2O(2分,写加热符号或不写“稀”不扣分)
(3)ⅤA(1分);P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱(2分,层数、
半径和能力答对两点给1分)
(4) SO2+NH3·H2O=HSO3-+NH4+(2分,反应物写成SO2+NH3+H2O不扣分)
(5) Al2O3+3 C+N2 2 AlN+3CO(2分)
2 AlN+3CO(2分)
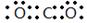 (1分)
(1分) 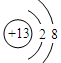 (1分)
(1分)(2)8 HNO3(稀)+3 Cu=2NO↑+3Cu(NO3)2+4H2O(2分,写加热符号或不写“稀”不扣分)
(3)ⅤA(1分);P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱(2分,层数、
半径和能力答对两点给1分)
(4) SO2+NH3·H2O=HSO3-+NH4+(2分,反应物写成SO2+NH3+H2O不扣分)
(5) Al2O3+3 C+N2
 2 AlN+3CO(2分)
2 AlN+3CO(2分)试题分析:X原子核外各层电子数之比为1:2,则X应该是碳元素。Y的氧化物和R的氧化物均能形成酸雨,则两种元素是N和S。Y的原子序数小于R的,因此Y是N,R是S。W和R是同周期相邻元素,且W的原子序数小于R的,所以W是P元素。Y原子和Z原子的核外电子数之和为20,则Z的原子序数是20-7=13,因此Z是Al元素。
(1)碳元素是第ⅣA族元素,则元素C的最高价氧化物是CO2,CO2分子中含有碳氧双键,所以其电子式为
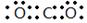 ;元素Al离子的核外电子数是10个,因此结构示意图为
;元素Al离子的核外电子数是10个,因此结构示意图为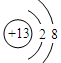 。
。(2)元素N的最高价氧化物对应水化物的稀溶液是稀硝酸,具有强氧化性,能氧化单质铜,反应的离子方程式为8 HNO3(稀)+3 Cu=2NO↑+3Cu(NO3)2+4H2O。
(3)P元素的原子序数是15,位于周期表的第三周期第ⅤA族;P原子和S原子的电子层数相同,位于同一周期。同周期自左向右原子半径逐渐减小,即P原子半径较大,所以得电子能力较弱,非金属性弱于S元素的非金属性。
(4)R的一种氧化物能使品红溶液褪色,该氧化物是SO2。氮元素的氢化物是氨气,溶于水显碱性,因此足量SO2通入到氨水反应的离子方程式为SO2+NH3·H2O=HSO3-+NH4+。
(5)反应中氧化铝与碳单质的物质的量之比为1:3,则根据原子守恒可知,生成物AlN与碳的物质的量之比是2:3,因此碳与氮气的物质的量之比是3:1,这说明反应还有CO生成,因此反应的化学方程式为Al2O3+3 C+N2
 2 AlN+3CO。
2 AlN+3CO。
练习册系列答案
相关题目