题目内容
(8分)用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
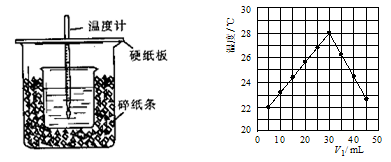
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
下列叙述正确的是
(3)V1=30mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。

下列叙述正确的是
| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
(1)环形玻璃棒(2分)
(2)B (2分)
(3)8℃(2分);①仪器保温性能差②实验中忽略了小烧杯、温度计所吸收的热量③计算中假定溶液比热容为4.2J/(g·℃),密度为 1g/cm3,实际上这是水的比热容和密度,酸碱溶液的比热容、密度略有不同(其它合理答案均可)(2分)。
(2)B (2分)
(3)8℃(2分);①仪器保温性能差②实验中忽略了小烧杯、温度计所吸收的热量③计算中假定溶液比热容为4.2J/(g·℃),密度为 1g/cm3,实际上这是水的比热容和密度,酸碱溶液的比热容、密度略有不同(其它合理答案均可)(2分)。
考查中和热的测定。
(1)在测定中和热时为了使溶液混合均匀,需要用环形玻璃搅拌棒。
(2)只有酸和碱恰好反应时,放出的热量才是最多的,溶液的温度才能最高。所以根据图像可知,当盐酸的体积是30ml时溶液温度最高,说明二者恰好反应,此时氢氧化钠的体积是20ml,所以氢氧化钠的浓度是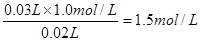 ,因此C不正确。由图像可判断,温度为22℃时盐酸的体积是5ml,氢氧化钠是45ml,因此实验时的环境温度应该小于22℃,A不正确。该实验不能说明有水生成的反应就是放热反应,D不正确。答案选B。
,因此C不正确。由图像可判断,温度为22℃时盐酸的体积是5ml,氢氧化钠是45ml,因此实验时的环境温度应该小于22℃,A不正确。该实验不能说明有水生成的反应就是放热反应,D不正确。答案选B。
(3)V1=30mL时HCl和NaOH恰好反应,此时产生的水是0.03mol,放出的热量是57.3KJ/mol×0.03mol=1.719kJ。所以根据Q=m×c×△t可知△t=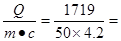 8℃。测定结果偏低,说明装置的保温性能较差,有热量损失。其次实验中忽略了小烧杯、温度计所吸收的热量。再就是计算中假定溶液比热容为4.2J/(g·℃),密度为 1g/cm3,实际上这是水的比热容和密度,酸碱溶液的比热容、密度略有不同。
8℃。测定结果偏低,说明装置的保温性能较差,有热量损失。其次实验中忽略了小烧杯、温度计所吸收的热量。再就是计算中假定溶液比热容为4.2J/(g·℃),密度为 1g/cm3,实际上这是水的比热容和密度,酸碱溶液的比热容、密度略有不同。
(1)在测定中和热时为了使溶液混合均匀,需要用环形玻璃搅拌棒。
(2)只有酸和碱恰好反应时,放出的热量才是最多的,溶液的温度才能最高。所以根据图像可知,当盐酸的体积是30ml时溶液温度最高,说明二者恰好反应,此时氢氧化钠的体积是20ml,所以氢氧化钠的浓度是
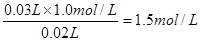 ,因此C不正确。由图像可判断,温度为22℃时盐酸的体积是5ml,氢氧化钠是45ml,因此实验时的环境温度应该小于22℃,A不正确。该实验不能说明有水生成的反应就是放热反应,D不正确。答案选B。
,因此C不正确。由图像可判断,温度为22℃时盐酸的体积是5ml,氢氧化钠是45ml,因此实验时的环境温度应该小于22℃,A不正确。该实验不能说明有水生成的反应就是放热反应,D不正确。答案选B。(3)V1=30mL时HCl和NaOH恰好反应,此时产生的水是0.03mol,放出的热量是57.3KJ/mol×0.03mol=1.719kJ。所以根据Q=m×c×△t可知△t=
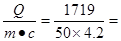 8℃。测定结果偏低,说明装置的保温性能较差,有热量损失。其次实验中忽略了小烧杯、温度计所吸收的热量。再就是计算中假定溶液比热容为4.2J/(g·℃),密度为 1g/cm3,实际上这是水的比热容和密度,酸碱溶液的比热容、密度略有不同。
8℃。测定结果偏低,说明装置的保温性能较差,有热量损失。其次实验中忽略了小烧杯、温度计所吸收的热量。再就是计算中假定溶液比热容为4.2J/(g·℃),密度为 1g/cm3,实际上这是水的比热容和密度,酸碱溶液的比热容、密度略有不同。
练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
 SO3(g) △H = -98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = -98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为