题目内容
少量的碘化物可以利用“化学放大”反应进行测定,其步骤如下:在中性或弱酸性溶液中用Br2将试样中I-完全氧化为IO3-,煮沸去掉过量的Br2,然后加入过量的KI,用CCl4萃取生成的I2(萃取率设为100%),用分液漏斗分去水层后,向油层加入肼(即联氨H2NNH2)的水溶液,在分液漏斗中振荡,使碘从CCl4层萃取至水层,且I2与联氨反应又生成I-,反应为:
2I2+H2NNH2→4I-+N2+4H+
然后,把水层分出,再向水层中加入过量Br2,又将I-氧化为IO3-,除去剩余Br2后,加入过量KI并酸化生成I2,加入淀粉作指示剂,用Na2S2O3标准溶液滴定,求得I-的含量,该滴定时的反应为:
![]() +I
+I![]() →
→![]() +2I-
+2I-
(1)写出离子方程式:
①I-被Br2氧化________。
②IO-3与I-生成碘________。
(2)经上述过程“化学放大”后,相当于把初始时的I-的量放大多少倍。
解析:
解:(1)①I-+3Br2+3H2O═IO3-+6Br-+6H+ ②IO3-+5I-+6H+═3I2+3H2O (2)5I-与IO-3生成3I2,把I-变为6个I原子放大6倍,再次放大又放大6倍,共36倍。 由题给信息I-被Br2氧化为IO3-时Br2被还原为Br-,配平离子方程式时要注意在反应物中补H2O,在生成物中加H+,在配平I-与IO3-生成I2的离子方程式时,留心题给的“酸化”条件。
|

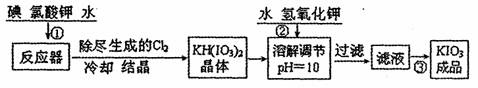
(11分)碘是人体的必需微量元素之一。加碘食盐中加重主的碘酸钾是一种白色结晶粉末,常温下很稳定。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质反应。
I.工业生产碘碳钾的流程如下:
|
已知步骤①发生反应为6I2+11KclO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
反应中还原剂是 (填化学式),转移电子数为 。
II、已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)检验加碘食物中的碘元素。
学生甲利用碘酸与碘化钾在酸性条件下发生反应,检验是否有碘单质生成所需要的试剂是 ,判断碘单质存在的现象是 ;若要进一步分离提纯碘单质,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量。学生乙设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Ns2S2O3溶液10.0mL,恰好完全反应(I2+2S2O2-3=2I-+S4O2-6)。则加碘食盐样品中的碘元素含量是 mg./kg(以含w的代数式表示)。
(3)有人认为可以用碘化钾代替食盐中的碘酸钾,学生丙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1ml0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再加入少量食醋,振荡。 | 溶液变蓝色 |
根据学生丙的实验结果,回答下列问题
①你认为能否用碘化钾代替食盐中的碘酸钾 (填“能、不能或不确定”)②你认为学生乙的实验结果 (填“偏高、偏低、无影响”)。