题目内容
7.将标准状况下33.6L Cl2通入500mL某浓度的NaOH溶液中恰好完全反应,测得溶液中的含氯微粒有Cl-、ClO-、ClO3-三种,且c(ClO-)=c(ClO3-).(1)用1个化学方程式表示出上述反应:4Cl2+8OH-=ClO-+ClO3-+6Cl-+4H2O,该反应中氧化剂和还原剂的物质的量之比为3:1.
(2)所用NaOH溶液的浓度为6mol•L-1.
分析 (1)设ClO-与ClO3-的物质的量为1mol、1mol,此时失去的电子的物质的量为6mol,根据得失电子数相等,生成的Cl-为6mol,那么被还原的氯元素为6mol,据此书写方程式,根据化合价的升降计算反应中氧化剂和还原剂的物质的量之比;
(2)根据公式c=$\frac{n}{V}$来计算即可.
解答 解:(1)设ClO-与ClO3-的物质的量为1mol、1mol,此时失去的电子的物质的量为6mol,根据得失电子数相等,生成的Cl-为6mol,那么被还原的氯元素为6mol,根据电荷守恒得到反应为:4Cl2+8OH-=ClO-+ClO3-+6Cl-+4H2O,反应中氧化剂和还原剂的物质的量之比是3:1,故答案为:4Cl2+8OH-=ClO-+ClO3-+6Cl-+4H2O;3:1;
(2)根据反应:4Cl2+8OH-=ClO-+ClO3-+6Cl-+4H2O,标准状况下33.6L Cl2的物质的量是1.5mol,消耗氢氧化钠是3mol,所用NaOH溶液的浓度c=$\frac{n}{V}$=$\frac{3mol}{0.5L}$=6mol/L,故答案为:6.
点评 本题考查学生氧化还原反应电子转移的计算以及方程式的书写和物质的量浓度的计算知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
17.活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下:
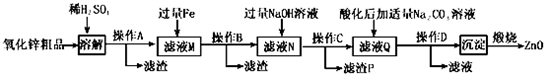
已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)操作A所用的玻璃仪器有烧杯、漏斗和玻璃棒.
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.

已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.
18.下列物质既能使溴的四氯化碳溶液褪色,又能与氢氧化钠溶液反应的是( )
| A. | CH3COOH | B. | CH3COOCH2CH3 | C. | CH2=CHCOOH | D. | 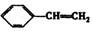 |
15.某工厂以孔雀石为主要原料制备蓝矾晶体(CuSO4•5H2O),其生产流程如图1所示:
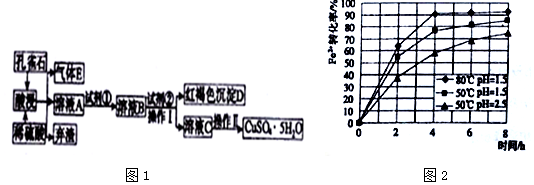
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如表所示:
回答下列问题:
(1)弃渣的主要成分是SiO2,Ⅱ中有“洗涤”的操作,其目的是除去晶体表面附着的杂质.
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,则试剂①最好为下列中的b,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
a.Na2O2b.H2O2 c.Cl2 d.KSCN
(3)根据图2有关数据,你认为工业上氧化操作时应采取措施将反应温度及溶液pH分别控制在80℃,pH=1.5,氧化时间为4h左右.
(4)操作Ⅰ中溶液的pH应控制在3.2≤pH<4.7范围内.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液进行滴定,则KMnO4溶液应置于酸(填“酸”或“碱”)式滴定管中.若滴定20.00mLA的溶液,用去0.0240mol•L-1KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+的浓度为0.096mol/L.

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如表所示:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
(1)弃渣的主要成分是SiO2,Ⅱ中有“洗涤”的操作,其目的是除去晶体表面附着的杂质.
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,则试剂①最好为下列中的b,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
a.Na2O2b.H2O2 c.Cl2 d.KSCN
(3)根据图2有关数据,你认为工业上氧化操作时应采取措施将反应温度及溶液pH分别控制在80℃,pH=1.5,氧化时间为4h左右.
(4)操作Ⅰ中溶液的pH应控制在3.2≤pH<4.7范围内.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液进行滴定,则KMnO4溶液应置于酸(填“酸”或“碱”)式滴定管中.若滴定20.00mLA的溶液,用去0.0240mol•L-1KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+的浓度为0.096mol/L.
2.在硝酸酸化的条件下,PbO2、NaBiO3、K2S2O8、Na4XeO6均可将Mn氧化为MnO4-,有关氧化剂则被还原为Pb2+、Bi3+、SO42-、Xe.若制得等物质的量的MnO4-,消化氧化剂物质的量最少的是( )
| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |
12.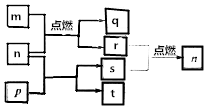 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )| A. | Y、Z、W的简单离子的电子层结构相同 | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | 简单氢化物的稳定性:X>Y | |
| D. | Y与Z两种元素形成的化合物一定只含离子键 |

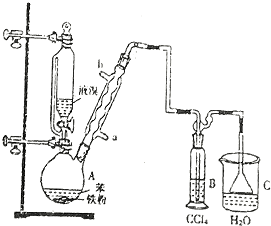
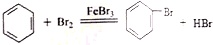 .
.