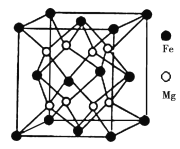
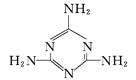
题目内容
【题目】已知T℃时AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
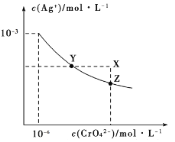
A.T℃时Ag2CrO4的Ksp=2×10-12
B.浓度均为2×10-5mol/LAgNO3溶液与NaCl溶液等体积混合没有沉淀生成
C.在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
D.保持温度T℃不变,Ag2CrO4溶液长时间放置可使溶液由X点到Z点
【答案】B
【解析】
试题分析:A.依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)2Ag+CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A错误;B.浓度均为2×10-5mol/LAgNO3溶液与NaCl溶液等体积混合时Qc=2×10-5mol/L×2×10-5mol/L=4×10-10(mol/L)2<2×10-10(mol/L)2,没有AgCl沉淀生成,故B正确;C.在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故C错误;D.保持温度T℃不变,Ag2CrO4溶液长时间放置后析出晶体Ag2CrO4,CrO42-浓度降低,无法使溶液由X点到Z点,故D错误,答案为B。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目